pH verschil zouten aantonen met gelatine
1.Onderzoeksvraag
Hoe kunnen met gelatine het verschil in pH van primaire, secundaire en tertiaire fosfaten aantonen?
2.Voorbereiding
a.Begrippen als achtergrond voor experiment
- pH: geeft de zuurtegraad van een oplossing weer (zuur of basisch)
- Zout (naamgeving): anorganische stofklasse bestaande uit een metaalion en een zuurrestion.
b.Materiaal + stoffen
- Petrischaal
- Maatbeker
- Kookplaat
- Lepel
- Weegschaal
- NaH2PO4
- Na3PO4
- Na2HPO4
- Universeelindicator
- NaCl
c.Bereiding oplossingen
Bereiding gelatine. Verwarm de aangegeven hoeveelheid water van op de verpakking. Voeg hier de gelatine aan toe totdat het volledig opgelost is. Voeg ook de universeelindicator toe. Giet de oplossing in de petrischaal en zet deze in de frigo/vriezer om af te koelen. Haal dit eruit als de gelatine hard is.
c.Opstelling (foto)

d.Etiketten

3.Uitvoeren
a.Werkwijze
- Vul de petrischaal met de gelatine
- Leg in een uithoek een paar korrels Na3PO4
- Leg in een andere uithoek een paar korrels NaH2PO Herhaal met Na2HPO4
- Leg in een andere uithoek een paar korrels NaCl (referentie)
- Laat dit een paar minuten staan.
b.Waarneming (+ foto’s)
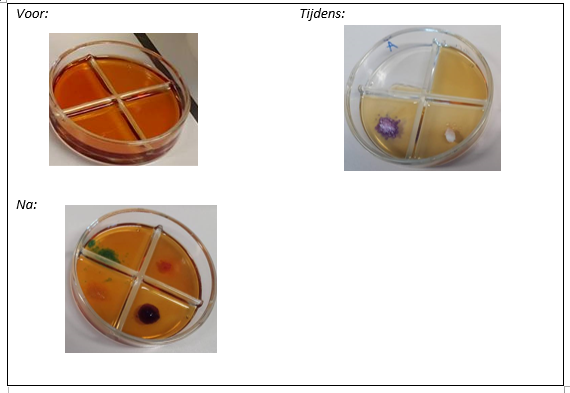
4.Reflecteren

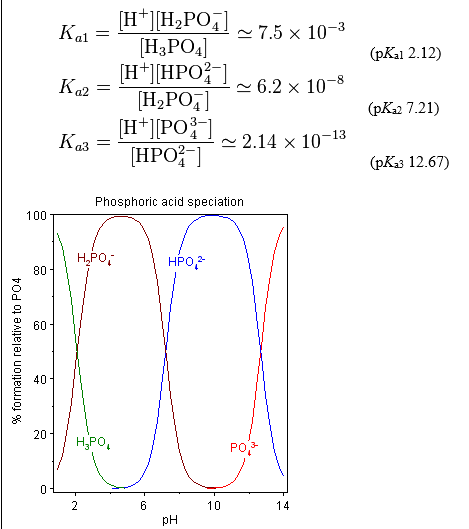
Wat in de gelatine gebeurt, is niet alleen het oplossen van een zout in water. In de gelatine zit ook universeelindicator die een reactie aangaat met de gevormde ionen. Er worden steeds Na+ ionen gedissocieerd, deze beïnvloeden de pH niet (ze zijn afkomstig van een sterk base NaOH). De negatieve ionen zorgen dus voor het verschil in pH-waarde. Deze negatieve ionen (H2PO4– of PO43-) gaan een reactie aan met water. Zo worden er H+ of OH– als reactieproduct gevormd waardoor het milieu respectievelijk zuur of basisch wordt. De universeelindicator neemt in ieder milieu een andere kleur aan. Voor NaCl is er geen verkleuring omdat beide ionen van een sterk zuur of sterke base komen, de ionen beïnvloeden de pH-waarde daarom niet.






