Permanganaat fontein
1.Onderzoeksvraag
Wat gebeurt er als we kaliumpermanganaat brengen in een mengsel van oxaalzuur en zwavelzuur.
2.Voorbereiding
a.Begrippen als achtergrond voor experiment
- Oxidatie
- Reductie
- Redoxreactie
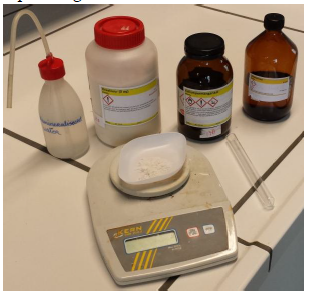
b.Materiaal + stoffen
- Kaliumpermanganaat
- Oxaalzuur 3%
- Verdund zwavelzuur
- Reageerbuis
- pH – papiertjes
- 2 bekerglazen 100 ml
c.Bereiding oplossingen
Maken van een 3% oxaalzuur oplossing. 30 g oxaalzuur oplossen in 1l water.
d.Opstelling (foto)
e.Etiketten

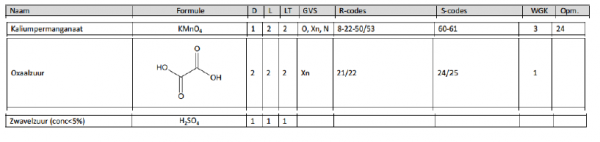
f..WGK code
- Kaliumpermanganaat 3
- Oxaalzuur 1
- Zwavelzuur 1
g.COS brochure
3.Uitvoeren
a.Werkwijze
- Giet 5 ml oxaalzuur in een reageerbuis
- Voeg 1 ml verdund zwavel zuur toe
- Laat een kristal kaliumpermanganaat in de buis vallen en observeer
b.Waarneming (+ foto’s)

4.Reflecteren
a.Optredende reacties
2 MnO4– (aq) + 5 H2C2O4(aq) + 6 H3O+ (aq) –> 2 Mn2+ (aq) + 10 CO2 (aq) + 14 H2O
MnO4– + 2 H2O + 3 e– –> MnO2 + 4 OH–
b.Besluit
Het permanganaat ion haalt elektronen van de oxaalzuur moleculen en oxideert daardoor het oxaalzuur. Het MnO4– ion gedraagt zich als een oxidator in deze reactie terwijl oxaalzuur de reductor is in deze reactie. Door elektronen over te dragen reduceert het het MnO4– ion tot Mn2+. Mn2+ ionen zijn kleurloos. De bruine kleur die na verloop van tijd gevormd wordt duidt op de aanwezigheid van Mn4+ ionen.
5. Aanvullingen
Gebruik maar heel weinig kaliumpermanganaat, anders is geen resultaat zichtbaar. Je kan ook verschillende fonteinen maken met verschillende hoeveelheden oxaalzuur.
Bronnen






