Oplosbaarheid van sulfaten en carbonaten
1.Onderzoeksvraag
Hoe verschilt de oplosbaarheid van sulfaten en carbonaten?
2.Voorbereiding
a.Materiaal + stoffen
- Mg(NO3)2.6H2O-oplossing 0,5 mol/l
- nucleonschaal
- Ca(NO3)2.4H2O-oplossing 0,5 mol/l
- leeg blad papier
- Sr(NO3)2-oplossing 0,5 mol/l
- potlood/pen
- Ba(NO3)2-oplossing 0,2 mol/l
- pipetten
- LiBr-oplossing 1 mol/l
- bekerglas
- NaCl-oplossing 0,5 mol/l
- gedemineraliseerd water
- KI-oplossing 0,1 mol/l
- weegschuitje
- Na2CO3-oplossing 0,5 mol/l
- balans
- Na2SO4-oplossing 0,5 mol/l
- spatel
b.Opstelling (foto)


c.Etiketten

3.Uitvoeren
a.Werkwijze
- Weeg de gevraagde hoeveelheid af in een weegschuitje.
- Neem een maatkolf van 100 ml (om 100 ml oplossing te bereiden).
- Hou het weegschuitje boven de maatkolf en spoel uit m.b.v. gedemineraliseerd water.
- Vul de maatkolf verder aan totdat de onderkant van de meniscus raakt aan de maatstreep.
- Sluit de maatkolf af met parafilm en homogeniseer.
- Giet de oplossing eventueel over in een fles met draaistop.
Hoeveelheden
– Mg(NO3)2.6H2O-oplossing 0,5 mol/l –> 12,82 g voor 100 ml
– Ca(NO3)2.4H2O-oplossing 0,5 mol/l –> 11,81 g voor 100 ml
– Sr(NO3)2-oplossing 0,5 mol/l –> 10,58 g voor 100 ml
– Ba(NO3)2-oplossing 0,2 mol/l –> 5,23 g voor 100 ml
– LiBr-oplossing 1 mol/l –> 8,68 g voor 100 ml
– NaCl-oplossing 0,5 mol/l –> 2,92 g voor 100 ml
– KI-oplossing 0,1 mol/l –> 1,66 g voor 100 ml
– Na2CO3-oplossing 0,5 mol/l –> 5,30 g voor 100 ml
– Na2SO4-oplossing 0,5 mol/l –> 7,10 g voor 100 ml
- Neem een leeg blad leg er een nucleonschaal op.
- Teken de tabel zoals bij de beginopstelling.
- Doe in alle linkse vakjes 2 druppeltjes natriumsulfaat.
- Doe in alle rechtse vakjes 2 druppetjes natriumcarbonaat.
- Doe vervolgens in de bovenste vakjes 2 druppels lithiumbromide.
- Doe in de volgende rij 2 druppeltjes natriumchloride.
- Vul volgende rijen ook aan en kijk wat er gebeurt.
b.Waarneming (+ foto’s)

4.Reflecteren
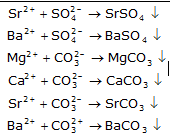
De oplosbaarheid van een stof hangt niet enkel af van het anion, maar van de combinatie van het anion en kation.
Lithium-, natrium-, magnesium-, calcium-verbindingen met sulfaationen lossen. Strontiumsulfaat en bariumsulfaatoplossingen zijn troebel. Lithium- en natrium-ionen vormen met carbonaationen geen neerslag. Magnesium-, calcium-, strontium- en barium- vormen een neerslag met carbonaationen.
5. Aanvullingen
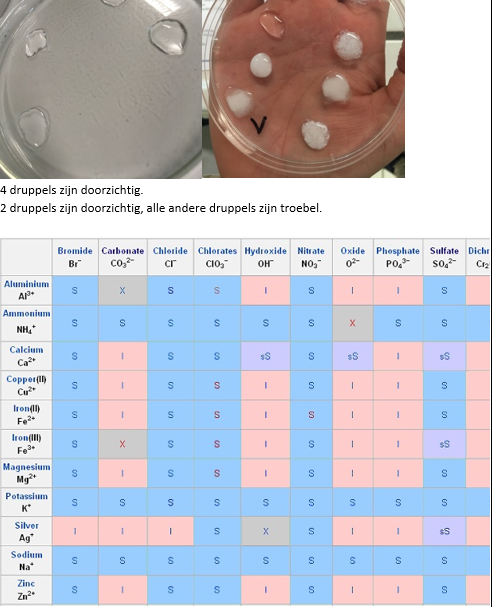
Gebruik een gekleurde achtergrond om de waarnemingen te doen, een witte neerslag is niet duidelijk zichtbaar op een witte achtergrond.
Het experiment kan ook op een nog kleinere schaal uitgevoerd worden a.d.h.v. druppels op een plastic mapje. De tabel kan dan afgedrukt of getekend worden op een gekleurd papier (anders zijn de witte neerslagen niet zichtbaar). De leerlingen moeten dan alleen maar een druppeltje laten vallen in het juiste vakje.






