Onderzoeksproject Bindingstypes identificeren
1.Onderzoeksvraag
Op welke manieren kunnen we een onbekende vaste stof identificeren?
2.Voorbereiding
Begrippen als achtergrond voor experiment
- Ionbinding,
- atoombinding en metaalbinding
- stofeigenschap
Materiaal + stoffen
- Natriumchloride
- Sacharose
- Koperdraad
- IJzervijlsel
- Bunsenbrander
- Timer
- Gedeïoniseerd water
- Water
- Accu met elektroden
Hoe bepalen we de stofeigenschappen?
Smeltpunt: Je kan het smeltpunt van een stof relatief bepalen door de tijd te meten om tot smelten te komen. Verwarm met een bunsenbrander ongeveer 1 gram vaste stof in een hittebestendige proefbuis. Stop met verwarmen van zodra de vaste stof smelt. Denk na over hoe je gaat bepalen of een stof begint te smelten. Verwarm geen enkele stof langer dan 5 minuten. Sommige stoffen zullen in dit tijdsbestek niet smelten.
Oplosbaarheid: De oplosbaarheid in water onderzoeken. Breng een spatelpunt van de vaste stof in een reageerbuis. Voeg ongeveer 5 milliliter gedeïoniseerd water toe. Bevestig een rubberen stop en schud voorzichtig.
Elektrische geleidbaarheid: De elektrische geleidbaarheid van de stof onderzoeken in vaste toestand en na het toevoegen van water. Beide elektroden moeten de vaste stof of de oplossing aanraken. Spoel na elke test de elektroden af met gedeïoniseerd water en droog zorgvuldig af.
Opstelling
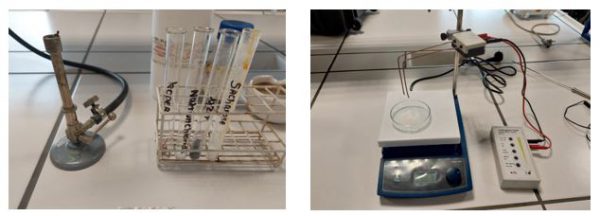
3.Uitvoeren
a. Werkwijze
De proef bestaat uit 3 sub experimenten. We gaan van elke stof het smeltpunt, de elektrische geleidbaarheid en de oplosbaarheid bepalen
Smelten:
- natriumchloride: nee
- Sacharose: ja: begon na enkele seconden boven de vlam al te smelten. Verbranding volgde niet veel later al. Na ongeveer 20s was alles verbrand.
- Na 15s (bruinige kleur op de zijkant, suiker is bijna volledig gesmolten
- Na 22s is de suiker volop aan het verbranden
- Na 40s is de suiker verbrand
- Ijzer: nee
- Koper: nee
Elektrische geleidbaarheid:
Opmerking: In water: water aangelengd tot een bodem van de petrischaal. Nadien even laten oplossen om dan de elektrische geleidbaarheid ervan te meten.
- Natriumchloride:
- In water: geleidend
- Zonder water: niet geleidend
- Sacharose:
- In water: niet geleidend
- Zonder water: niet geleidend
- Ijzer:
- In water: geleidend
- Zonder water: geleidend
- Koper:
- In water: geleidend
- Zonder water: geleidend
Oplosbaarheid:
- Natriumchloride: ja
- Sacharose: ja
- Ijzer: nee
- Koper: nee
b. Waarnemingen



4.Reflecteren
- Smeltpunt: het smeltpunt van een atoomverbinding ligt veel lager dan dat van een metaalverbinding en onverbinding.
- Elektrische geleidbaarheid: metalen geleiden altijd een elektrische stroom. Atoomverbindingen meestal niet (uitzondering grafiet) en ook opgelost in water geleiden ze geen elektrische stroom. Ionverbindingen geleiden enkel opgelost in water een elektrische stroom ofwel in vloeibare toestand.
- Oplosbaarheid: metalen lossen niet op in water. ionbverindingen lossen soms op in water, afhankelijk van de roosterkrachten en atoomverbindingen (polaire moleculen) lossen ook soms op in water.






