Onderzoek:
Invloed van de concentratie op de reactiesnelheid van calciumcarbonaat met zoutzuur
1.Onderzoeksvraag
Wat is de invloed van de concentratie op de reactiesnelheid van calciumcarbonaat met zoutzuur?
2.Voorbereiding
Calciumcarbonaat is een onoplosbare vaste stof en heeft geen effect op de reactiesnelheid.
De concentratie HCl zal afnemen naarmate er meer calciumcarbonaat opgebruikt wordt. Om de invloed van de concentratie zoutzuur op de reactiesnelheid te onderzoeken, volstaat het dus deze snelheid te bepalen op verschillende momenten tijdens de reactie.
Materialen en stoffen
- 1 erlenmeyer 300 ml
- 1 maatkolf 500 ml
- Gegradueerde pipet 10 ml
- Weegschuitje
- Weegschaal
- Pasco Airlink met Pasport sensor voor druk ->
- HCl 2,0 mol/l
3.Uitvoeren
a. Werkwijze
- We gebruiken kalkpellets gemaakt uit coccolieten, het exoskelet van ééncellige mariene algen. Deze werden vroeger ook gebruikt om schoolkrijt te maken. Het huidige schoolkruit bestaat vooral uit gips (CaSO4) en is minder geschikt.
- Vul de erlenmeyer van 300ml tot aan de rand met kraantjeswater. Plaats de afsluitdop er voorzichtig op en laat overtollig water wegstromen.Giet de erlenmeyer leeg in een maatcilinder van 500ml en lees volume af. Trek van deze waarde 50ml af en schrijf dit op.
- We maken 50ml HCl oplossing met concentratie 0.4M
- We moeten eerst het gasvolume bepalen in de erlenmeyer. We hebben dat nodig bij de toepassing van de algemene gaswet
- Giet de oplossing uit in de erlenmeyer van 300ml.
- Weeg 3g CaCO3 pellets af in een weegschuitje.
- Meet met de sensor na toevoeging van de pellets aan de zoutzuuroplossing.Plaats de erlenmeyer met zoutzuur-oplossing voor je op de tafel.Neem de afsluitdop met druksensor in de ene hand.Neem het weegschuitje met coccoliet-kalk in de andere hand. Voeg de kalk bij de oplossing en sluit ONMIDDELLIJK af met de afsluitdop.Zorg ervoor dat de stop niet wegschiet door de stijgende druk. Hou hem op z’n plaats met de hand.
- Doe de meting.. Als de curve niet meer stijgt kun je de meting stoppen.
b. Waarnemingen
- Bereid een Excel sheet voor met deze indeling
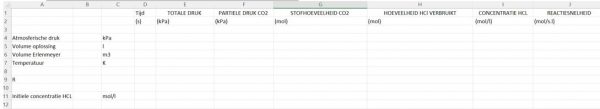
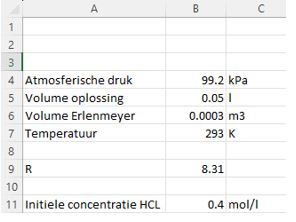
- Vul de waarden in kolom B aan: De atmosferische druk en het volume van de erlenmeyer hangen van je meting af en zijn niet noodzakelijk gelijk aan dit voorbeeld.
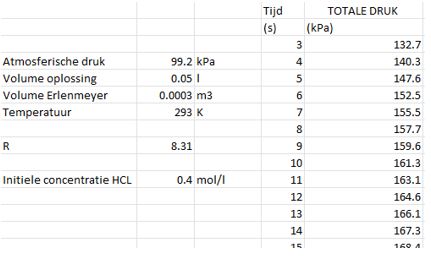
- Importeer de gegevens uit de meting.
- De CSV file met de meetresultaten bevat een lijst met totale drukmetingen per seconde.
- Kopieer deze metingen vanaf de eerste meting waar de druk begon te stijgen (het moment waarop we de erlenmeyer afsloten) en plak deze in kolom E.
- Kolom D geef je opeenvolgende waarden startend vanaf 1 :
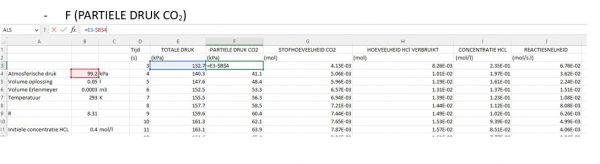
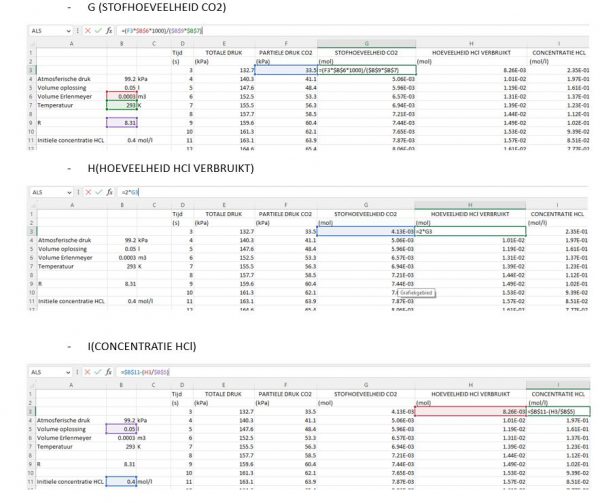
 Automatiseer de berekeningen
Automatiseer de berekeningen
- We stellen de Excel sheet nu zo in dat de berekeningen uit hoofdstuk 3 worden uitgevoerd. Hieronder zie je de formules die naar elke rij kunnen worden gekopieerd.
- Maak een grafiek van de concentratie HCl in de tijd. Selecteer “Invoegen” en “Spreidings of bellendiagram” bij “grafieken”:
- Plaats de lege grafiek rechts naast de tabel en klik erop met de rechtermuisknop.
- Kies “gegevens selecteren”
- Kies “Toevoegen” bij legendagegevens (reeks):
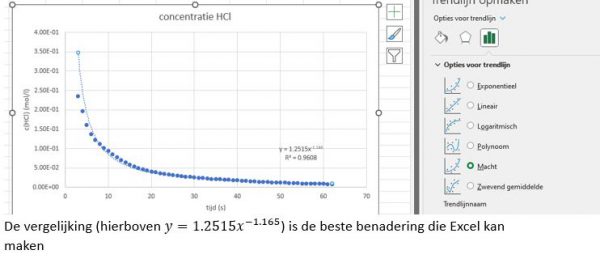
- Voor de reeks x-waarden selecteer je kolom D met de seconden (zonder hoofding, enkel de waarden) voor de reeks y-waarden selecteer je kolom I met de concentraties HCl (zonder hoofding, enkel de waarden)
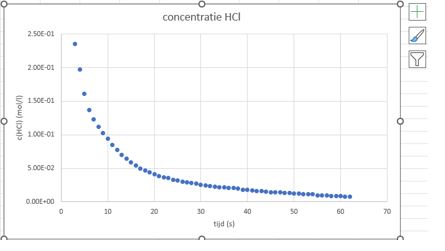
- Je krijgt nu een grafiek. Voeg de gepaste titels toe via de + aan de rechterkant van de grafiek.
- De vergelijking van de grafiek vinden.
- Klik rechts op de punten van de grafiek. Je kan nu kiezen om een trendlijn toe te voegen. Vink “Vergelijking in de grafiek weergeven” en “R-Kwadraat in de grafiek weergeven” aan.
- lecteer het trendlijntype met de hoogst R2 waarde:
 12. De ogenblikkelijke snelheid
12. De ogenblikkelijke snelheid
- We hebben nu de concentratie HCl in functie van de tijd. Om de onmiddellijke reactiesnelheid te vinden moeten we hier eerst de afgeleide van nemen. (x is de tijd in sec, y de concentratie van HCl in mol/l)
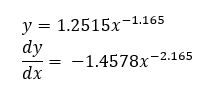
- Zoals aangetoond in de strategie moeten we nog het teken omdraaien en delen door de coëfficiënt van HCl in de reactievergelijking.

We hebben nu de reactiesnelheid in functie van de tijd.
- We hebben nu de concentratie HCl in functie van de tijd. Om de onmiddellijke reactiesnelheid te vinden moeten we hier eerst de afgeleide van nemen. (x is de tijd in sec, y de concentratie van HCl in mol/l)
- Om deze grafiek te kunnen maken voegen we nog een kolom toe aan ons rapport. Kolom J zal voor ons de reactiesnelheid berekenen gebruik makende van de bovenstaande formule. Voor “x” substitueren we kolom D:
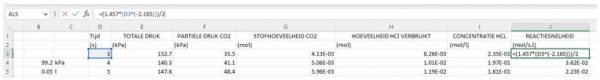
- We kunnen nu weer een grafiek opstellen zoals in punt 5. Ditmaal gebruiken we voor de x-waarden kolom I met de concentratie HCl en voor de y-waarden onze resultaten uit kolom J voor de reactiesnelheid.
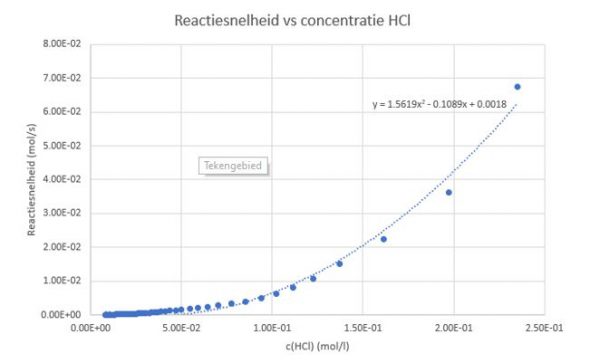
- lecteer het trendlijntype met de hoogst R2 waarde:
- Klik rechts op de punten van de grafiek. Je kan nu kiezen om een trendlijn toe te voegen. Vink “Vergelijking in de grafiek weergeven” en “R-Kwadraat in de grafiek weergeven” aan.
4. Besluit
In elk geval toont bovenstaande grafiek aan dat hoe hoger de concentratie HCl in de oplossing is hoe hoger de reactiesnelheid.
Tijdens ons experiment daalt snelheid omdat zoutzuur wordt opgebruikt en de concentratie daalt.
Voor onze reactie is de snelheidsvergelijking gegeven door

β = 0 aangezien CaCO3 onoplosbaar is. We zouden k(T) en de orde moeten kunnen aflezen uit onze laatste trendlijn.






