Omkeerbare reacties
1.Onderzoeksvraag
Hoe kunnen we aantonen dat de volgende evenwichtsreactie “2 Fe3+ + 2 I– <–> 2 Fe2+ + I2 “plaatsvindt?
a. Materiaal + stoffen
Materiaal en stoffen deel 1:
- 5 pasteurpipetten
- Spatel
- 1 nunclonschaaltjes met 12 openingen
- 1 erlenmeyers met stop
- Alcoholstift
- Bekerglas
- ijzer(III)chloride-oplossing (1,0 mol/l)
- kaliumjodide-oplossing (0,50 mol/l)
- Indicatoroplossing: Kaliumhexacyanoferraat(III)oplossing (0,10 mol/l)
- Indicatoroplossing: Kaliumthiocyanaatoplossing (1,0 mol/l)
- Indicatoroplossing: Zetmeeloplossing (1,0 % (m/V))
- Indicatoroplossing: zilvernitraatoplossing (1,0 % (m/V)
Materiaal en stoffen deel 2:
- 4 pasteurpipetten
- Spatel
- 1 nunclonschaaltjes met 12 openingen
- 1 erlenmeyers met stop
- Alcoholstift
- Bekerglas
- Dijoodoplossing in ethanol (2% (m/V)
- ijzer(II)sulfaat poeder
- Indicatoroplossing: Kaliumhexacyanoferraat(III)oplossing (0,10 mol/l)
- Indicatoroplossing: Kaliumthiocyanaatoplossing (1,0 mol/l)
- Indicatoroplossing: Zetmeeloplossing (1,0 % (m/V))
- Indicatoroplossing: zilvernitraatoplossing (1,0 % (m/V)
b.Opstelling (foto)

3.Uitvoeren
a.Werkwijze
- Werkwijze deel 1 van het onderzoek:
- Verdeel 5 openingen van de eerste nunclonschaal in de volgende categorieën met de alcoholstift:
- Categorie 1: K3Fe(CN)6: Aan basismengsel 1 voeg je kaliumhexacyanoferraatoplossing toe.
- Categorie 2: Zetmeel: Aan basismengsel 1 voeg je zetmeeloplossing toe.
- Categorie 3: KSCN: Aan basismengsel 1 voeg je kaliumthiocyanaatoplossing toe.
- Categorie 4: AgNO3: Aan basismengsel 1 voeg je zilvernitraatoplossing toe.
- Categorie 5: Referentie: Aan basismengsel 1 doe je GEEN toevoegingen.
- Nummer de eerste erlenmeyer met het cijfer 1. Hierin zal basismengsel 1 bereid worden.
- De bereiding van basismengsel 1:
- Breng met een pasteurpipet 5 druppels FeCl3 – oplossing in de erlenmeyer. (Maak de pasteurpipet direct na gebruik schoon, zodat de oplossing niet in het plastic kan vreten.)
- Breng vervolgens met een 2de pasteurpipet 10 druppels KI-oplossing in dezelfde erlenmeyer.
- Leng de erlenmeyer aan met gedemineraliseerd water tot de maatstreep van 50 ml.
- Zwenk het mengsel.
- Breng 3 ml van basismengsel 1 in elk van de 5 gecategoriseerde openingen van de eerste nunclonschaal.
- Breng in de 1ste 4 gecategoriseerde openingen van de eerste nunclonschaal met 4 verschillende pasteurpipetten 6 druppels van de overeenkomstige indicatoroplossingen:
- Categorie 1: K3Fe(CN)6 – oplossing
- Categorie 2: Zetmeel – oplossing
- Categorie 3: KSCN – oplossing
- Categorie 4: AgNO3 – oplossing
Werkwijze deel 2 van het onderzoek:
- Verdeel de 5 openingen van de tweede nunclonschaal in de volgende categorieën met de alcoholstift:
- Categorie 1: K3Fe(CN)6: Aan basismengsel 2 voeg je kaliumhexacyanoferraatoplossing toe.
- Categorie 2: Zetmeel: Aan basismengsel 2 voeg je zetmeeloplossing toe.
- Categorie 3: KSCN: Aan basismengsel 2 voeg je kaliumthiocyanaatoplossing toe.
- Categorie 4: AgNO3: Aan basismengsel 2 voeg je zilvernitraatoplossing toe.
- Categorie 5: Referentie: Aan basismengsel 2 doe je GEEN toevoegingen.
- Nummer de tweede erlenmeyer met het cijfer 2. Hierin zal basismengsel 2 bereid worden.
- De bereiding van basismengsel 2:
- Breng met een pasteurpipet 2 ml I2 in ethanol – oplossing in de erlenmeyer.
- Breng vervolgens een spatelpunt FeSO4 in de erlenmeyer
- Leng de erlenmeyer aan met gedemineraliseerd water tot de maatstreep van 50 ml.
- Zwenk het mengsel tot het FeSO4 is opgelost.
- Breng 3 ml van basismengsel 2 in elk van de 5 gecategoriseerde openingen van de tweede nunclonschaal.
- Breng in de 1ste 4 gecategoriseerde openingen van de tweede nunclonschaal met de 4 verschillende pasteurpipetten, die gebruikt zijn bij deel 1, 6 druppels van de overeenkomstige indicatoroplossingen:
- Categorie 1: K3Fe(CN)6 – oplossing
- Categorie 2: Zetmeel – oplossing
- Categorie 3: KSCN – oplossing
- Categorie 4: AgNO3 – oplossing
- Doe de waarnemingen.
- Verdeel 5 openingen van de eerste nunclonschaal in de volgende categorieën met de alcoholstift:
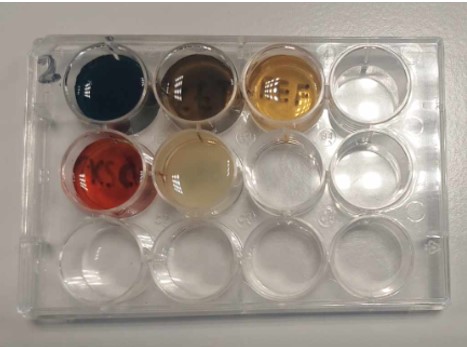
b.Waarneming en besluit (+ foto’s)
Deel1
Deel2
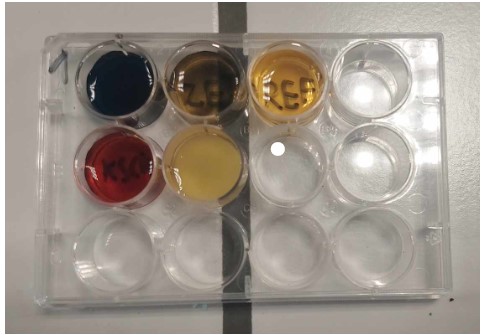
Bij een chemisch evenwicht zijn dus zowel de reactieproducten als de reagentia aanwezig. Bij de hierboven beschreven reactie treedt er inderdaad een evenwicht op, want zowel de reagentia als de reactieproducten (Fe3+, I–, Fe2+ en I2) zijn aanwezig in beide basismengsels.
De optredende reacties zijn:
2 FeCl3 + 2 KI –> 2 FeCl2 + I2 + 2 KCl
Reactie met kaliumhexacyanoferraat(III): 3 Fe2+ + 2 Fe(CN)63- –> Fe3(Fe(CN)6)2
Reactie met KSCN: Fe3+ + SCN– –> FeSCN2+
Reactie met Ag(NO3) : Ag+ + I– –> AgI
Reactie met zetmeel: I2 + zetmeel à blauw complex






