Observeren van chemische reacties
1.Voorbereiding
a.Materiaal + stoffen
- Geplastificeerd blad
- Pipetten
- Vergrootglas
- Ba(NO3)2 0,2 mol/l
- (NH4)2SO4 0,5 mol/l
- NH3 3 mol/l
- Na2SO4 0,5 mol/l
- Pb(CH3COO)2 0,5 mol/l
- HCl 1 mol/l
- NaOH 1 mol/l
- KMnO4 0,01 mol/l
- AgNO3 0,1 mol/l
- CuSO4 0,2 mol/l
- FeSO4 0,2 mol/l
- Fe(N03)3 0,2 mol/l
- KSCN 0,2 mol/l
- Zn korrels
b.Opstelling (foto)
2.Uitvoeren
a.Werkwijze
- Maak bijgevoegd blad en plastificeer.
- Breng 2 druppels Ba(NO3)2 in box1 en voeg hieraan 2 druppels Na2SO4
- Voeg twee druppels Pb(NO3)2 in box2 en voeg hieraan 2 druppels KI
- Breng 2 druppels Fe(NO3)3 in box3. Voeg hieraan 1 druppel KSCN oplossing
- Breng 2 druppels CuSO4 oplossing in box4. Voeg hieraan 2 druppels NH3
- Breng 2 druppels NH4VO3 in box5. Voeg hieraan 1 druppel HCl en dan een klein stukje zink metaal.
- Breng 2 druppels FeSO4 in box6. Voeg hieraan 2 druppels NaOH oplossing
- Voeg 2 druppels KMnO4 oplossing in box7. Voeg hieraan 2 druppels FeSO4 oplossing
- Breng 2 druppels Ba(NO3)2 in box8. Voeg hieraan 2 druppels NaOH oplossing
- Breng 1 druppel AgNO3 in box9. Voeg hieraan 1 druppel FeSO4.
- Voeg 2 druppels CuSO4 in box10. Voeg hieraan een stukje zinkmetaal.
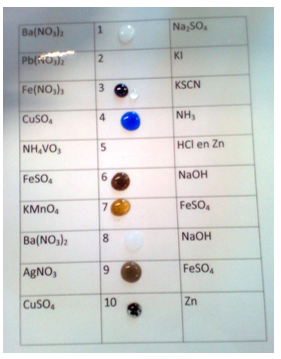
b.Waarneming (+ foto’s)
3.Reflecteren
- Vorming van witte BaSO4
- Vorming van PbI2 gele neerslag
- Vorming van Fe(SCN)2+ rode neerslag
- Vorming van Cu(NH3)42+ diep blauw complex
- Vorming van het grijze Fe(OH)2. Geleidelijk ontstaat het bruine Fe(OH)3 door oxidatie met de lucht.
- Het fel paarse KMnO4 verandert geleidelijk via het bruine MnO2 naar het kleurloze Mn2+
- Er ontstaat Ba(OH)2. Dit is oplosbaar in het begin. Geleidelijk aan wordt CO2 geabsorbeerd van de lucht waardoor het onoplosbare BaCO3 ontstaat onder de vorm van een witte schijn aan het oppervlak.
- Aan het oppervlak ontstaat het metallische zilver door de reductie van AgNO3 en vorming van Fe3+
- Het oppervlak van het zink wordt roodbruin van het koper. De oplossing wordt lichter blauw door het verdwijnen van CuSO4.






