Neerslag van calciumfosfaat
Filmfragment
1.Onderzoeksvraag
Hoe beïnvloedt natriumcitraat de reactie tussen een calciumchlorideoplossing, water en een kaliumfosfaatoplossing ?
2.Voorbereiding
Materiaal + stoffen
- Bekerglazen van 100 ml (2)
- Maatcilinder (4)
- Trechters (4)
- Water
- Calciumchloride dihydraat
- Kaliumfosfaat
- Natriumcitraat
Opstelling (foto)

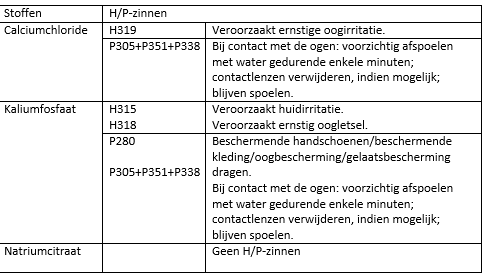
Veiligheid
3.Uitvoeren
a.Werkwijze
- Breng in twee bekerglazen telken 20 ml 0,1 mol/l caliumchloride oplossing.
- Breng in de eerste 40 ml water en in de tweede 40 ml 0,1 mol/l natriumcitraatoplossing.
- Voeg nu aan de beide nog 20 ml kaliumfosfaatoplossing 0,1 mol/l.
b.Waarneming (+ foto’s)
In de eerste beker ontstaat een neerslag, in de tweede een heldere oplossing

4.Reflecteren
De citraationen bouwen met de calciumionen een stabiel complex. De concentratie van de vrije Ca-ionen daalt hierdoor zo sterk dat het oplosbaarheidsproduct van calciumfosfaat niet wordt overschreden waardoor neerslagvorming uitblijft.
3 CaCl2 + 2 Na3C6H5O7 –> Ca3(C6H5O7)2 + 6 NaCl
3 CaCl2 + 2 Na3PO4 –> Ca3(PO4)2 + 6 NaCl
Essentiële reactievergelijking : 3 Ca2+ + 2 PO43- –> Ca3(PO4)2
De Kw-waarde (oplosbaarheidsproduct) van 1,0 10-25 wordt hierdoor niet bereikt.
5.Onderwerpen:
- neerslagvorming
- inwerking op de evenwichtsreactie bij neerslagvorming
-
Bronnen






