Microschaalexperiment buffers
1.Onderzoeksvraag
Hoe kunnen we een buffermengsel aantonen door toevoeging van een oplossing?
2.Voorbereiding
a. Materiaal + stoffen
- Pipetjes van 3 ml.
- Nunclon 24 well
- Roerstaafje
- Maatbeker met water
- Zakdoekje
- Universeel indicator in druppelflesje (UI)
- HCl 0,1 mol/ (10ml )
- NaOH 0,1 mol/l(10ml)
- NaCl 1 mol/l (10ml)
- Gedestilleerd water in spuitfles
- NaH2PO4/Na2HPO4-buffer met pH = 7
b.Opstelling (foto)

3.Uitvoeren
a.Werkwijze
- Breng in de vakjes A1, B1 en C1 van het vakkendoosje 1 ml gedestilleerd water.
- Breng in de vakjes A2, B2 en C2 1 ml NaCl (1 ).
- Breng in de vakjes A3, B3 en C3 de bufferoplossing met pH 7.
- Let erop dat je geen vloeistof in de verkeerde vakjes laat terechtkomen.
- Het minste druppeltje verkeerd verstoort de waarneming.
- Breng nu in elk van de 9 vakjes ook 1 druppel UI.
- Plaats het vakkendoosje op een witte ondergrond.
- Noteer de kleur en de benaderende pH-waarde van elke vloeistof in tabel1.
- Voeg nu aan vakje A1 druppel per druppel HCl 0,1
- Roer met het inoxstaafje na elke druppel.
- Tel het aantal druppels dat je toevoegt.
- Stop als een nieuwe druppel geen kleurverandering meer veroorzaakt.
- Noteer het aantal toegevoegde druppels in de onderstaande tabel.
- Spoel hierna het inoxstaafje af in het bekertje met water en droog het af met absorberend papier.
- Herhaal met vakje A2 en A3.
- Doe nu hetzelfde met vakjes B1 tot B3, maar met NaOH 0,1 als reagens.
- Vul nu de vakjes C1 tot C3 met gedestilleerd water.
- Noteer nu de uiteindelijke kleuren en de overeenkomstige pH waarden in tabel2.
b.Waarneming en besluit (+ foto’s)
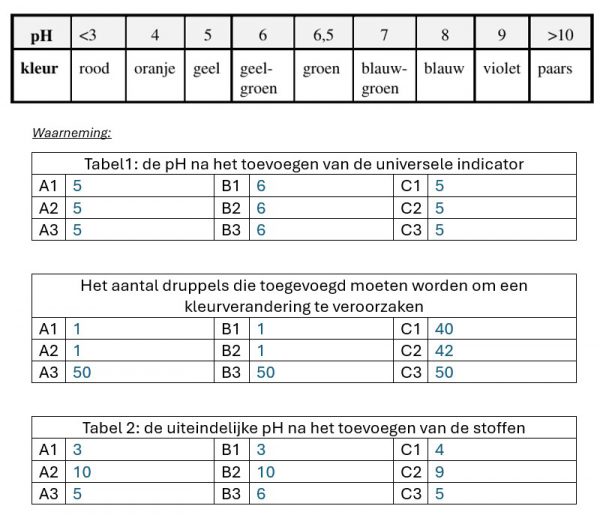
Oplossing A is het buffermengsel
De buffermengsels zitten helemaal rechts. Er moeten meer druppels van een zuur of base toegevoegd worden voordat er een kleurverandering is.
In vakjes A3,B3 en C3 zit het buffermengsel. Er is veel meer HCl of NaOH nodig om de pH te doen veranderen. Dit is te verklaren a.d.h.v. de formule van de pH van buffers 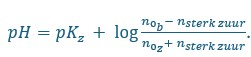
. Er is veel meer NaOH en HCl nodig om een pH-verandering te veroorzaken.
Bij NaCl en het gedestilleerde water in vakjes A1, A2,B1,B2,C1 en C2 verandert de pH wel dit komt door deze formule: pH= – log c. Elke druppel die je toevoegt aan deze oplossing geeft een pH-verandering.
In de vakjes C1,C2 en C3 wordt er gedestilleerd water toegevoegd. Deze heeft een pH van 7 en gaat dus geen verandering veroorzaken






