Kristallisatie in snel tempo
1.Onderzoeksvraag
Hoe kunnen we op een snellere manier zoutkristallen maken?
2.Voorbereiding
a.Begrippen als achtergrond voor experiment
- Neutralisatiereactie: reactietype tussen zuur en base waarbij water en een zout de reactieproducten zijn.
- Zout: anorganische stofklasse bestaande uit een metaalion en een zuurrestion.
- Verdampen: fysisch proces waarbij een stof van vloeibare fase naar de gasfase over gaat.
- Kristalliseren: fase waarbij losse ionen zich gaan ordenen om in een vaste toestand te geraken.
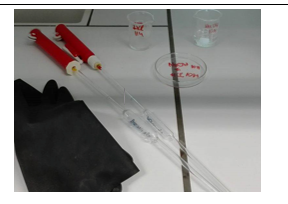
b.Materiaal + stoffen
- Petrischaal
- Zwart blad
- Microscoop
- Glazen buret
- Zuur handschoenen
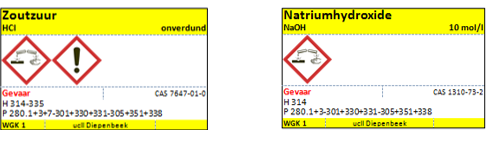
- NaOH 40% = 10mol/l
- HCl (geconcentreerd 37% ~ 10.5 mol/l)
c.Opstelling (foto)
d.Etiketten
3.Uitvoeren
a.Werkwijze
- Leg de petrischaal op het zwarte blad.
- Laat 2 druppels NaOH op de petrischaal vallen.
- Laat hierop 2 druppel HCl op vallen.
- Laat dit een 5-tal minutenin de zuurkast staan.
- Neem de petrischaal en zet deze onder de microscoop.
b.Waarneming (+ foto’s)

4.Reflecteren
NaOH is een base en HCl is een zuur, wanneer deze reageren met elkaar wordt er NaCl en H2O gevormd (neutralisatiereactie). Doordat deze stoffen zeer geconcentreerd zijn, komt er ook warmte vrij (reactie-enthalpie) zodat het water sneller kan verdampen. De vrije ionen Na+ en Cl– kunnen zo in een ionenrooster geplaatst worden. Door het gebruik van de hoge concentraties ga je zodanig veel zout maken dat de zoutoplossing (je reactieproduct) verzadigd raakt en je dus het gevormde zout kan zien.






