Kleurige ontleding
1.Onderzoeksvraag
Hoe kunnen we bij de ontleding van water zuur en basisch milieu met indicatoren aantonen?
2.Voorbereiding
Materiaal + stoffen
- Petrischaaltje bijvoorbeeld Ø 7 cm / 12 mm hoog
- Spanningsbron 9 V DC / 200 mA
- Elektriciteitsdraad met krokodilklemmetjes
- Dun plankje 11 cm x 11 cm
- Reageerbuis, roerstaaf
- Platina (Pt) draden Ø 0,5mm / 8 cm: 2
- Ged. water (H2O): 20 mL
- Natriumsulfaat (Na2SO4•10H2O): 2 gram
- Broomthymolblauwoplossing 0,1%:1 mL
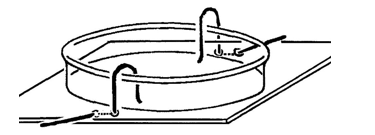
Opstelling (foto)
Etiketten

3.Uitvoeren
a.Werkwijze
- Neem een stukje triplex – dik karton kan ook – van ca. 10 cm x 10 cm. Boor midden aan een zijde, 1 cm van de rand, 2 kleine gaatjes, en doe dat ook aan de tegenoverliggende zijde. Buig platina draadjes door de gaatjes zoals op de tekening hierboven. Zet het petrischaaltje op het plankje en buig aan beide zijden de platinadraad tot de bodem van de schaal. Het is beter als de draad de opstaande rand van het petriglas niet raakt, want door capilaire werking kan er vloeistof weglekken. Verbind de andere kanten van de platina draden (elektroden) met de (nog uitgeschakelde) spanningsbron d.m.v. de krokodilklemmen en de elektriciteitsdraad.
- Los in een grote reageerbuis 2 gram natriumsulfaat(decahydraat) op in wat water en vul aan tot 20 mL. Schenk over in de petrischaal.
- Maak, indien nodig, indicatoroplossing door 10 milligram broomthymolblauw op te lossen in 10 mL ged. water; doe deze oplossing in een flesje met een druppelpipet.
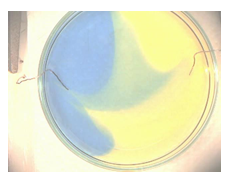
- Voeg met de druppelpipet 1 mL broomthymolblauw-indicator toe aan de petrischaal. De oplossing wordt geelgroenig. Schakel nu de stroom in. Je ziet kleine belletjes aan beide draden in het groene water. Al spoedig verkleurt dit rondom de draadjes: aan de ene kant wordt het geel, aan de andere kant blauw. Laat dit een tijdje zo doorgaan. Schakel dan de stroom uit.
- Vervolgens roer je alles weer door elkaar en het geheel wordt weer groenig. Je kunt alles weer herhalen door de stroom opnieuw in te schakelen, eventueel omgepoold.
b.Waarneming (+ foto’s)
Er worden H+ -ionen gevormd aan de positieve pool en OH– -ionen gevormd aan de negatieve pool. Aan de positieve pool krijgen we dus een meer zurige oplossing, geel, en aan de negatieve pool krijgen we een meer basische oplossing, blauw.
4.Reflecteren
Dankzij de ionen in de zoutoplossing kan er een stroom lopen. Aan de positieve draad ontstaat zuurstof en aan de negatieve waterstof: er vindt ontleding van het water plaats. Maar aan de positieve kant ontstaat aldus een overvloed aan H+-ionen en aan de negatieve kant een overvloed aan OH¯-ionen. Dus in de omgeving van de anode wordt de oplossing zuur en bij de kathode wordt die basisch. Dat zie je aan de kleur die de indicator aanneemt: geel voor zuur en blauw voor basisch.
Als je alles door elkaar roert, neutraliseren het zuur en de base elkaar en alles wordt weer als vanouds.
In plaats van broomthymolblauw is lakmoes of kookvocht van rode kool ook bruikbaar.
De positieve pool wil elektronen opnemen, is oxidator, wil reageren met water als enige aanwezige reductor.
Water kan als reductor reageren met potentiaal +1,77 of +1,23. Deze laatste is de sterkste reductor, dus:
2 H2O → O2 + 4 H+ + 4 e¯
De elektronen gaan naar de pluspool en verdwijnen daar uit de oplossing. De H+-ionen kleuren het broomthymolblauw geel.
De negatieve pool wil elektronen afstaan. Hij reageert met een oxidator. Als oxidators zijn aanwezig Na+, H+ en SO42- waarbij SO42- de sterkste is. Je zou dus verwachten dat SO42- zou reageren. Maar SO42- wordt door zijn lading door de minpool afgestoten. Aldus blijft er water over als sterkste (-0,83) oxidator. Het reageert als volgt:
2 H2O + 2 e¯ → H2 + 2 OH¯
De elektronen worden geleverd door de minpool. De OH¯-ionen kleuren het broomthymolblauw blauw.






