Identificatie van een Ca- of Ba-ion in een oplossing
1.Onderzoeksvraag
Hoe kunnen we in een oplossing Ba2+ van Cu2+ ionen onderscheiden?
2.Voorbereiding
a. Materiaal + stoffen
- Koper(II)nitraat
- Bariumnitraat
- Natriumsulfaat
- Demi-water
- Drie proefbuisjes
- Proefbuisrekje
- Roerstokje
- Pasteurpipet
Bereiding oplossingen
- Voeg een mespuntje van het kopernitraat toe aan het proefbuisje met demi-water.
- Voeg een mespuntje van het bariumnitraat toe aan het proefbuisje met demi-water.
- Voeg een mespuntje van het natriumsulfaat toe aan het proefbuisje met demi-water.
3.Uitvoeren
a.Werkwijze
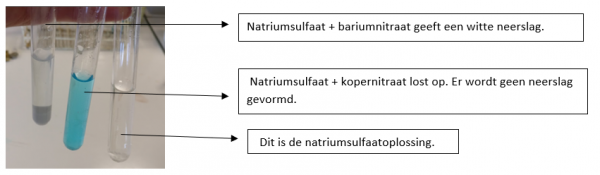
- Neem met de pasteurpipet 1 ml natriumsulfaatoplossing en voeg dit toe aan de bariumnitraatoplossing. Kijk wat er gebeurt.
- Neem met de pasteurpipet 1 ml natriumsulfaatoplossing en voeg dit toe aan de kopernitraatoplossing. Kijk wat er gebeurt.
b.Waarneming (+ foto’s)
4.Reflecteren
Oplossing van Ba(NO3)2 in water:
Ba(NO3)2 –> Ba2+ + 2NO3–
Oplossing van Cu(NO3)2 in water:
Cu(NO3)2 –> Cu2+ + 2NO3–
Oplossing van natriumsulfaat in water:
Na2SO4 –> 2Na+ + SO42-
Ionenreactie van natriumsulfaat + bariumnitraat:
2Na+ + SO42- + Ba2+ + 2NO3– –> BaSO4 ↓
Ionenreactie van natriumsulfaat + kopernitraat:
2Na+ + SO42- + Cu2+ + 2NO3– –> 2Na+ + SO42- + Cu2+ + 2NO3–
Essentiële ionenreactie van natriumsulfaat + bariumnitraat:
SO42- + Ba2+ –> BaSO4 ↓
Essentiële ionenreactie natriumsulfaat + kopernitraat:/
Stoffenreactievergelijking van natriumsulfaat + bariumnitraat:
Ba(NO3)2 + Na2SO4 –> BaSO4 ↓ + NaNO3
Stoffenreactievergelijking van natriumsulfaat + kopernitraat:
Cu(NO3)2 + Na2SO4 –> NaNO3 + CuSO4
Bariumnitraat (Ba(NO3)2) is een oplosbaar zout. Bij het oplossen ervan komen de barium- en de nitraationen uit het rooster vrij. Ba(NO3)2 –> Ba2+ + 2NO3–
Kopernitraat (Cu(NO3)2) is een oplosbaar zout. Bij het oplossen ervan komen de koper en de nitraationen uit het rooster vrij. Cu(NO3)2 –> Cu2+ + 2NO3–
Ook natriumsulfaat (Na2SO4) is een oplosbaar zout. Bij het oplossen ervan komen de natrium en de sulfaationen uit het rooster vrij. Na2SO4 — 2Na+ + SO42-
BaSO4 is een onoplosbaar zout omdat de krachten tussen Ba2+ en SO42- zeer groot zijn. Vermits beide ionen in het mengsel aanwezig zijn zal dus een rooster van BaSO4 gevormd worden: er ontstaat een neerslag van BaSO4SO42- + Ba2+ –> BaSO4 ↓
CuSO4 vormt geen onoplosbaar zout. De ionen trekken elkaar niet genoeg aan en lossen gewoon op in water.
5. Aanvullingen
https://nl.wikipedia.org/wiki/Neerslagreactie#Toepassingen_van_neerslagreacties






