Identificatie van een buffermengsel
1.Onderzoeksvraag
Hoe kunnen we experimenteel een buffermengsel identificeren?
2.Voorbereiding
a. Materiaal + stoffen
- Koffielepel
- 4 maatbekers van 100ml
- 2 maatcilinders van 250ml
- pH-sensor verbonden aan meetinstrument
- Spuitfles
- Azijnzuuroplossing (0,1 mol/l)
- Gedestilleerd water
- Natriumacetaat
- Natriumchloride
- Natriumhydroxide-oplossing (1 mol/l)
- Zoutzuuroplossing (HCl) (1 mol/l)
b.Opstelling (foto)

3.Uitvoeren
a.Werkwijze
- Maak een oplossing A: 50 ml 0,10 azijnoplossing + afgestreken koffielepel natriumacetaat
- Maak een oplossing B: 50 ml water + afgestreken koffielepel natriumchloride
- Giet de helft van oplossing A in een andere maatbeker van 100ml
- Voeg steeds 0,5,10,15,20 druppels HCl-oplossing (1 mol/l) in oplossing A en meet na elke toevoeging de pH met het meetinstrument.
- Noteer de meetresultaten in de eerste tabel.
- Voeg steeds 0,5,10,15,20 druppels NaOH-oplossing (1 mol/l) in oplossing A en meet na elke toevoeging de pH met het meetinstrument.
- Noteer de meetresultaten in de eerste tabel.
- Giet de helft van oplossing B in een andere maatbeker van 100ml.
- Voeg steeds 0,5,10,15,20 druppels HCl-oplossing (1 mol/l) in oplossing B en meet na elke toevoeging de pH met het meetinstrument.
- Noteer de meetresultaten in de tweede tabel.
- Voeg steeds 0,5,10,15,20 druppels NaOH-oplossing (1 mol/l) in oplossing B en meet na elke toevoeging de pH met het meetinstrument.
- Noteer de meetresultaten in de tweede tabel.
b.Waarneming en besluit (+ foto’s)
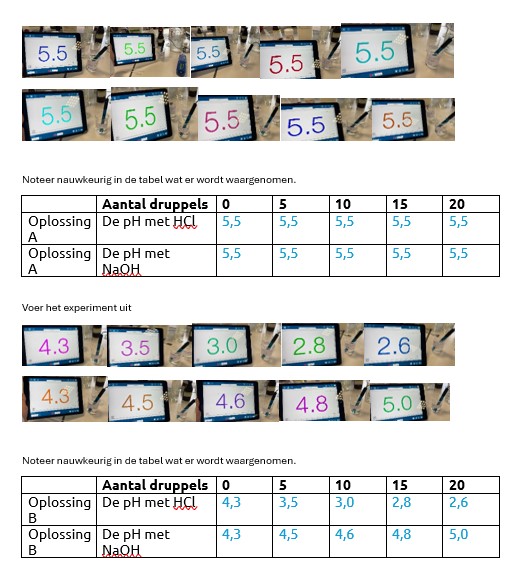
Oplossing A is het buffermengsel






