Hygroscopische werking van zwavelzuur
1.Onderzoeksvraag
Wat gebeurt er als we geconcentreerd zwavelzuur toevoegen aan gehydrateerd kopersulfaat?
2.Voorbereiding
a.Begrippen als achtergrond voor experiment
- Hygroscopisch (wateraantrekkend)
- Geconcentreerd
- Gehydrateerd
b.Materiaal + stoffen
- Horlogeglas
- Geconcentreerd zwavelzuur
- Kristallen CuSO4.5H2O
c.Opstelling (foto)
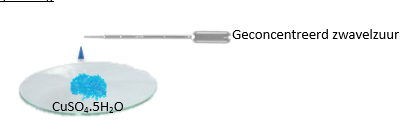
3.Uitvoeren
a.Werkwijze
- Breng enkele kristallen CuSO4.5H2O op een horlogeglas.
- Bevochtig met enkele druppels geconcentreerd zwavelzuur.
- Stel de kleurverandering vast.
b.Waarneming (+ foto’s)

4.Reflecteren
Zwavelzuur onttrekt het water van het gehydrateerd kopersulfaat. Hierdoor verliest het kopersulfaat zijn blauwe kleur!
Dit kleureffect wordt veroorzaakt doordat het Cu2+-ion gehydrateerd kan worden.
In de watervrije, witte vorm is het omgeven door sulfaationen. In de gehydrateerde vorm bevinden zich een aantal watermoleculen tussen het koperion en de sulfaat-ionen. Het verschil in coördinatie leidt tot een verandering in energietoestanden van de d-elektronen van het koperion en daarmee tot andere optisch eigenschappen.
[CuSO4.5H2O] + H2SO4 –> CuSO4 + 5H2O + H2SO4
Dit is een dehydraterende reactie!
5. Aanvullingen
- Watervrij koper(II)sulfaat wordt gebruikt om sporen van water in sommige vloeistoffen aan te tonen, omdat het zout, na contact met water, de karakteristieke blauwe kleur verkrijgt.
Bronnen






