Enkele redoxreacties
1.Voorbereiding
a.Materiaal + stoffen
- KBr 0,2 mol/l
- KI 0,2 mol/l
- NaCl 0,2 mol/l
- AgNO3 0,1 mol/l
- CuSO4 0,2 mol/l
- FeSO4 0,2 mol/l
- KSCN 0,1 mol/l
- zetmeeloplossing 1%
- Fe(NO3)3 0,2 mol/l
b.Opstelling (foto)
2.Uitvoeren
a.Werkwijze
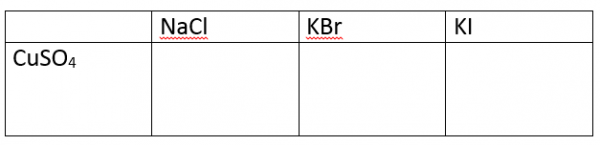
- Maak bijhorende tabel op papier en plastificeer
- Breng 1 druppel CuSO4 in elk van de vakjes
- Voeg nu 1 druppel NaCl in vak1, 1 druppel KBr in vak2 en 1 druppel KI in vak3
- Observeer
- Voeg na een aantal minuten telkens 1 druppel zetmeel toe.
Onderzoek 2
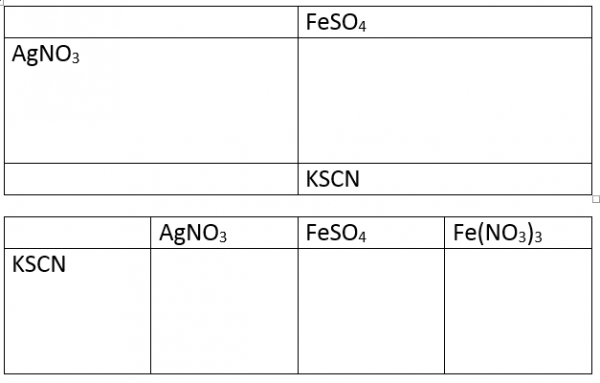
- Maak bijhorende tabel op papier en plastificeer
- Voeg 1 druppel AgNO3 in het vakje
- Voeg hieraan 1 druppel Fe(II) oplossing toe en observeer
- Voeg na een minuut 1 druppel KSCN oplossing toe en observeer
Om een verklaring te vinden kan bovenstaande tabel worden gemaakt op papier en geplastificeerd.
Voeg in vak1 AgNO3, in vak2 1 druppel FeSO4 en in vak 3 Fe(NO3)3. Voeg nu telkens 1 druppel KSCN toe en observeer.
b.Waarneming (+ foto’s)

3.Reflecteren
Er treedt geen reactie op tussen de koper(II)oplossing en het bromide of chloride. Toevoeging aan KI geeft een licht bruine neerslag van CuI. Toevoeging van een zetmeeloplossing geeft een blauw-zwarte kleur wat aangeeft dat dijood is gevormd.
2 Cu2+ + 4I– –> 2 CuI + I2
Toevoeging van Fe(II) aan AgNO3 geeft Ag-metaal aan te duiden met de glittering.
De toevoeging van een druppel KSCN geeft een rode kleur wat aangeeft dat Fe(III) is ontstaan. Ook een witte neerslag van AgSCN ontstaat.






