Endotherme reactie met zwavel
1.Onderzoeksvraag
Hoe kunnen we een spontane endotherme reactie uitvoeren met zwavel?
2.Voorbereiding
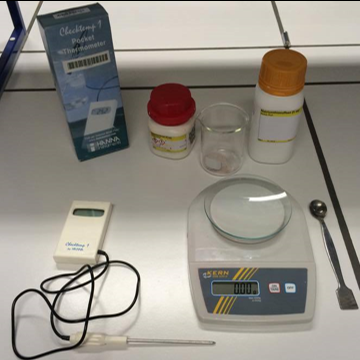
a.Materiaal + stoffen
- beker 100ml
- Fe(NO3)3.9H2O
- Na2S2O3.5H2O
- thermometer
b.Opstelling (foto)
c.Etiketten

3.Uitvoeren
a.Werkwijze
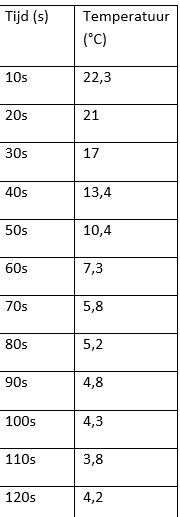
- Breng in een bekerglas van 100ml 10,1 g Fe(NO3)3.9H2O met 9.3 g Na2S2O3.5H2O als vaste stof samen.
- Na korte tijd ontstaat een suspensie met het gele zwavel en het donkerbruine ijzertrihydroxide.
- Meet met een thermometer de temperatuursverandering.
b.Waarneming (+ foto’s)

We zien dat de vaste stoffen geleidelijk aan veranderen in een bruine suspensie. Als we aan het bekerglas voelen merken we dat dit ook koud aanvoelt.
4.Reflecteren
2Fe(NO3)3·9H2O + 3 Na2S2O3·5H2O –> 2 Fe(OH)3 + 6 NaNO3 + 3 SO2 + 3 S + 30 H2O
De drijfkracht van de reactie is het vrijzetten van water uit beide zouten en de vorming van SO2. Tijdens het proces valt thiosulfaat uiteen in SO2 en S.De entropie neemt door de gasvorming toe waardoor het endotherme proces spontaan verloopt.