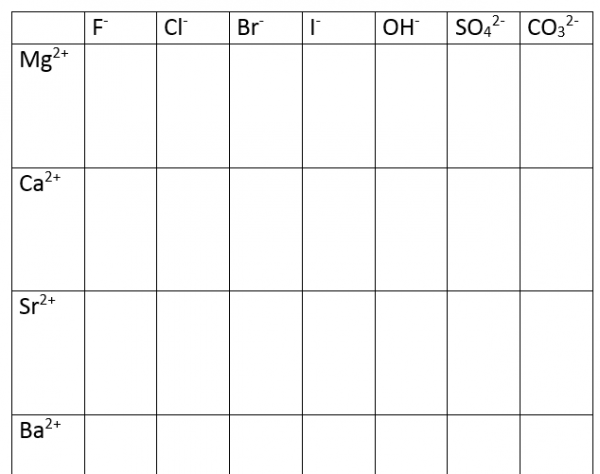
Eigenschappen van elementen uit groepIIa
1.Voorbereiding
a.Materiaal + stoffen
- Mg(NO3)2 0,5 mol/l
- Ca(NO3)2 0,5 mol/l
- Sr(NO3)2 0,5 mol/l
- Ba(NO3)2 0,5 mol/l
- NaOH 1 mol/l
- KF 0,5 mol/l
- NaCl 0,5 mol/l
- KBr 0,2 mol/l
- KI 0,2 mol/l
- Na2CO3 0,5 mol/l
- Na2SO4 0,5 mol/l
b.Opstelling (foto)
2.Uitvoeren
a.Werkwijze
- Print bovenstaande tabel af en plastificeer het blad
- Voeg 1 druppel Mg-oplossing in elk vak van de Mg ionen rij
- Herhaal dit met Ca-oplossing, Sr-oplossing en Ba-oplossing
- Voeg nu telkens 1 druppel F-oplossing in de eerste-kolom
- Herhaal dit met de andere anionenoplossingen.
b.Waarneming (+ foto’s)

3.Reflecteren
Met magnesiumionen ontstaan geen neerslagen. Alle gevormde oplossingen zijn kleurloos
Met calciumionen ontstaat een witte neerslag met de carbonaationen. Er vormt zich geen neerslag met chloride, bromide en jodide maar een sluier neerslag ontstaat met fluoride.
De Ca(OH)2 is eerst doorzichtig maar na een aantal minuten wordt ze troebel door de vorming van CaCO3, dit door het absorberen van CO2 uit de lucht.
Ca(OH)2 + CO2 –> CaCO3 + H2O
CaSO4 is bij deze concentraties oplosbaar.
Bij Sr-ionen zijn de sulfaat en carbonaatzouten onoplosbaar en vormt zich een witte neerslag.
De halogeniden zijn oplosbaar behalve fluoride. Sr(OH)2 is eerst kleurloos en na enige tijd troebel omwille van dezelfde reden als bij Ca.
De sulfaat- en carbonaatzouten van barium vormen onmiddellijk neerslagen.
De halogeniden zijn oplosbaar behalve fluoride. De hydroxide is eerst helder, na verloop ontstaat een neerslag door vorming van BaCO3.






