Eigenschappen van buffermengsels
1.Onderzoeksvraag
: Hoe kunnen we buffermengsels aantonen aan de hand van toevoegingen?
2.Voorbereiding
a. Materiaal + stoffen
- 4 proefbuizen
- universele indicator
- 3 beralpipetten
- een proefbuisrekje
- 4 bekers:
- Water (beker A)
- NaCl (c = 0,10 mol/l)) (5,9 g/l )) (beker B)
- buffer met pH 5,8 (beker C)
- buffer met pH 8,5 (beker D)
- 3 erlenmeyers:
- water
- HCl (c = 0,10 mol/l ))
- NaOH (c = 0,10 mol/l )
b.Opstelling (foto)

3.Uitvoeren
a.Werkwijze
- Voeg in elke proefbuis 1 druppel universele indicator.
- 1) Voeg in elke proefbuis 3ml van beker A
- Voeg aan de eerste proefbuis verder niks toe.
- Voeg aan de tweede proefbuis 3 ml water uit de erlenmeyer toe.
- Voeg aan de derde proefbuis 3 druppels HCl (c = 0,10 )
- Voeg aan de vierde proefbuis 3 druppels NaOH (c = 0,10 )
Kijk nu door elke proefbuis door een blad papier en determineer de pH (in de tabel)
- 2) Voeg in elke proefbuis 3ml van beker B
- Voeg aan de eerste proefbuis verder niks toe.
- Voeg aan de tweede proefbuis 3 ml water uit de erlenmeyer toe.
- Voeg aan de derde proefbuis 3 druppels HCl (c = 0,10 )
- Voeg aan de vierde proefbuis 3 druppels NaOH (c = 0,10 )
Kijk nu door elke proefbuis door een blad papier en determineer de pH (in de tabel)
- 3) Voeg in elke proefbuis 3ml van beker C
- Voeg aan de eerste proefbuis verder niks toe.
- Voeg aan de tweede proefbuis 3 ml water uit de erlenmeyer toe.
- Voeg aan de derde proefbuis 3 druppels HCl (c = 0,10 )
- Voeg aan de vierde proefbuis 3 druppels NaOH (c = 0,10 )
Kijk nu door elke proefbuis door een blad papier en determineer de pH (in de tabel)
- 4) Voeg in elke proefbuis 3ml van beker D
- Voeg aan de eerste proefbuis verder niks toe.
- Voeg aan de tweede proefbuis 3 ml water uit de erlenmeyer toe.
- Voeg aan de derde proefbuis 3 druppels HCl (c = 0,10 )
- Voeg aan de vierde proefbuis 3 druppels NaOH (c = 0,10 )
b.Waarneming en besluit (+ foto’s)
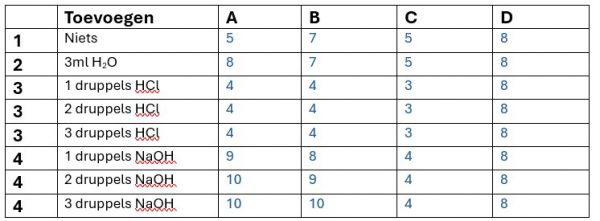
Geef een verklaring van de waargenomen verschijnselen in de vier oplossingen A, B, C en D.
- Water heeft een pH van 7. De formule voor de pH te berekenen: pH= – log c. Bij elke toevoeging van een zuur of een base verandert dus de pH. Water heeft geen invloed op de pH.
- Keukenzoutoplossing heeft een pH van 7. Bij elke toevoeging van een zuur of een base verandert dus de pH. Keukenzoutoplossing heeft geen invloed op de pH.
- Er gaat dus veel HCl toegevoegd moeten worden voordat het buffermengsels van pH verandert.
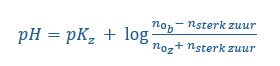
- De formule voor de pH van een buffer is . Er gaat dus veel HCl of NaOH toegevoegd moeten worden voordat het buffermengsels van pH verandert.







