Een keukenmengsel onderscheiden van een buffermengsel
1.Onderzoeksvraag
Op welke manier kunnen we een keukenzoutoplossing onderscheiden van een bufferoplossing?
a. Materiaal + stoffen
- Keukenzoutoplossing met pH = 7
- Zelfgemaakte bufferoplossing met pH = 7
- Methyloranje-indicator
- HCl-oplossing (0,10 mol/l )
- fenolftalëine indicator
- NaOH- oplossing (0,10 mol/l )
- 4 proefbuizen
- Proefbuisrek
- Pasteurpipet
b.Opstelling (foto)

3.Uitvoeren
a.Werkwijze
- Nummer vier proefbuizen.
- Breng met een pasteurpipet 5,0 ml keukenzoutoplossing in de genummerde proefbuizen 1 en 3.
- Breng met een ander pipet 5,0 ml bufferoplossing (pH=7) in de genummerde proefbuizen 2 en 4.
- Breng twee druppels methyloranje indicator in de genummerde proefbuizen 1 en 2.
- Voeg aan de proefbuizen 1 en 2 druppel per druppel HCl-oplossing (0,10 mol/l )toe tot de kleur van de oplossing verandert.
- Schud even met de proefbuis na iedere toevoeging.
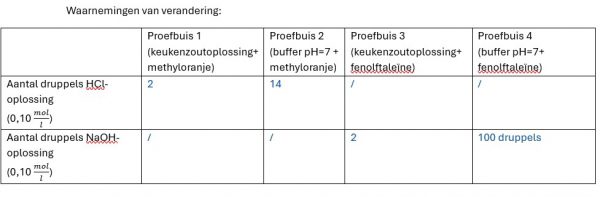
- Noteer voor iedere proefbuis hoeveel druppels je moet toevoegen om de kleurverandering te veroorzaken.
- Breng twee druppels fenolftalëine indicator in de genummerde proefbuizen 3 en 4.
- Voeg aan de proefbuizen 3 en 4 druppel per druppel NaOH-oplossing (0,10 mol/l )toe tot de kleur van de oplossing verandert.
- Schud even met de proefbuis na iedere toevoeging.
- Noteer voor iedere proefbuis hoeveel druppels je moet toevoegen om de kleurverandering te veroorzaken.
- Vergelijk het aantal druppels zuur dat je moet toevoegen in proefbuizen 1 en 2 om een blijvende kleurverandering van methyloranje te veroorzaken.
- Vergelijk het aantal druppels base dat je moet toevoegen in proefbuizen 3 en 4 om een blijvende kleurverandering van fenolftaleïne te veroorzaken.
- Omschrijf de invloed van de buffer op de pH van een oplossing.
b.Waarneming en besluit (+ foto’s)



Bij een buffer is de formule voor de pH: 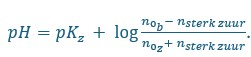
als we dit gaan invullen krijgen we 7 = 7,2 + 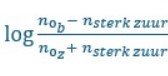
Het geheel moet -0,2 zijn om 7 te bekomen. Als we HCl toevoegen bij de oplossing met methyloranje zien we dat het omslaggebied bij 4 ligt. We moeten dus van pH=7 zakken tot pH= 4. We moeten hiervoor veel HCl toevoegen.
Hetzelfde bij het toevoegen van NaOH. Bij NaOH ligt het omslaggebied bij 10. De pH moet dus stijgen van 7 naar 9. Om naar pH=9 te gaan moet er veel NaOH toegevoegd worden.
Bij het keukenzout is de formule pH= -. log c dus elke druppel die je gaat toevoegen heeft invloed op de pH.






