De opkomende, rode halve maan
1.Onderzoeksvraag
Wat gebeurt er als ijzer(III)chloride en kaliumthiocyanaat diffunderen in water? Dit zelfde kan voor FeCl2 met K4Fe(CN)6 . 3 H2O en CoCl2 / Co(NO3)2 met K3Fe(CN)6.
2.Voorbereiding
a.Materiaal + stoffen
- Spatel
- 3 Petrischalen
Rode halve maan:
- Demiwater
- Kaliumthiocyanaat (KSCN)
- Ijzer(III)chloride
Blauwe halve maan:
- K4Fe(CN)6 . 3 H2O of K3Fe(CN)6
- FeCl2
Bruine halve maan:
- CoCl2 / Co(NO3)2
- K3Fe(CN)6 of K2Fe(CN)6
b.Opstelling (foto)

c.Etiketten

3.Uitvoeren
a.Werkwijze
Rode halve maan
Vul een petrischaal met demiwater (bodempje).
Leg aan de ene kant van de schaal een spatelpunt KSCN en diametraal daartegenover een spatelpunt FeCl3
Blauwe halve maan
Als de voorgaande proef met geelbloedloogzout, K4Fe(CN)6 in plaats van kaliumthiocyanaat.
Je kunt ook hetzelfde bekomen met het samenbrengen van FeCl2 en K3Fe(CN)6 (roodbloedloogzout).
Bruine halve maan
Als het voorgaande proef, maar nu met CoCl2 en K3Fe(CN)6
Dit kan ook met CoCl2 en K2Fe(CN)6.
b.Waarneming (+ foto’s)

Na enige tijd (1minuut, soms langer) wordt in het midden, aan de rand van de zich uitbreidende lichtgele vlek van FeCl3, een rode streep zichtbaar die de vorm van een halve maan.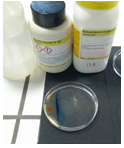
Gebruikt men heet water, dan verloopt de diffusie sneller.
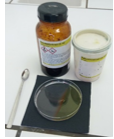
Een rode en gele cirkel bewegen zich naar elkaar toe. Als ze elkaar raken ontstaat een zwartbruine maansikkel.
4.Reflecteren
FeCl3 + 3 KSCN –> Fe(SCN)3 + 3 KCl
4 FeCl2 + 2 K4Fe(CN)6 –> Fe4(Fe(CN)6)2 + 8 KCl
3 Co(NO3)2 + 2 K3Fe(CN)6 –> Co3(Fe(CN)6)2 + 6 KNO3
Wat gebeurt er als ijzer(III)chloride en kaliumthiocyanaat diffunderen in water? Dit hetzelfde voor FeCl2 met K4Fe(CN)6 . 3 H2O en CoCl2 / Co(NO3)2 met K3Fe(CN)6.
Wanneer de 2 stoffen d.m.v diffusie met elkaar in contact komen ontstaat er een rode streep, blauwe streep, bruine streep in de vorm van een maan.
Dit kan sneller als we warm water gebruiken.






