De klassieke blauwe kolf
1.Voorbereiding
a.Materiaal + stoffen
- 1 liter erlenmeyer met rubber stop
- 10 g glucose
- 12 g vast NaOH
- 0.1 massa% methyleenblauwoplossing in ethanol
2.Uitvoeren
a.Werkwijze
- Maak een oplossing van 0.05 g methyleenblauw in 50 ml ethanol. Dit geeft een 0.1% oplossing.
- Weeg 12 g vast NaOH af in een erlenmeyer welke afsluitbaar is. Voeg water toe tot het volume ongeveer 300 ml is.
- Voeg 10 g glucose toe en schud tot alles goed is opgelost.
- Voeg kort voor de uitvoering 5 ml toe van de methyleenblauwoplossing. Geen van de hoeveelheden moet precies worden afgemeten. Er ontstaat een blauwe oplossing die in enkele minuten kleurloos wordt. Zet de stop stevig op de kolf .
- Na krachtig schudden ontstaat een blauwe kleur die langzaam verdwijnt.
- Opnieuw krachtig schudden geeft de blauwe kleur terug, die weer na enige tijd verdwijnt…
- Het kleureffect wordt minder na ongeveer 20 keer schudden.
- Na verloop van tijd wordt de stop weggenomen om extra zuurstofgas toe te voegen. Na enkele uren wordt de inhoud van de kolf geel en zijn geen kleurveranderingen meer te zien.
b.Waarneming (+ foto’s)

3.Reflecteren
Methyleenblauw is een aromatische verbinding die opgelost in water blauw kleurt. Het is een redoxindicator die een duidelijke kleurverandering ondergaat op een specifieke potentiaal.
Glucose wordt in een alkalische oplossing langzaam geoxideerd door zuurstof met vorming van gluconzuur. In aanwezigheid van natriumhydroxide is gluconzuur omgezet naar natriumgluconaat.
Methyleenblauw versnelt de reactie door te fungeren als een zuurstoftransfer agens.
HOCH2(CHOH)4CHO + 3 OH – —> HOCH2(CHOH)4CO2 + 2 H2O + 2 e –
Methyleenblauw wordt gereduceerd tot een kleurloze vorm.
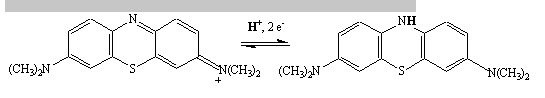
Als er niet voldoende zuurstof aangeleverd wordt bv als de fles teveel gevuld is dan zal zich geen blauwe kleur vormen. Indien men heel goed kijkt zal men een lichte blauwkleuring kunnen zien aan het oppervlak van de oplossing. In een afgesloten fles is op een gegeven moment alle zuurstof verbruikt en zal er geen kleurverandering meer plaatsvinden. Daarom is het belangrijk om verse oplossingen te gebruiken.






