Chemisch stoplicht
FILMFRAGMENT
1.Onderzoeksvraag
Hoe kunnen we aan de hand van chemische reacties een oplossing de kleuren van een stoplicht krijgen?
2.Voorbereiding
a.Begrippen als achtergrond voor experiment
- Oxidator: een chemische stof die in een chemische reactie elektronen kan opnemen.
- Reductor: een chemische stof die in een chemische reactie elektronen kan afstaan.
- Oxidatie: een chemisch proces waarbij een stof (de reductor) elektronen afgeeft aan een andere stof (de oxidator) waarbij het oxidatiegetal van de reductor toeneemt.
- Reductie: is het scheikundige proces waarbij een deeltje elektronen opneemt.
- Functionele groepen: onderdelen van moleculen met een structureel motief, herkenbaar aan de vaste elementensamenstelling en de covalente bindingen.
- Ketonen: een functionele groep, bestaande uit een carbonylgroep waaraan twee koolstofatomen zijn gebonden.
b.Materiaal + stoffen
-
Maatkolf met platte bodem 250 ml
-
Stop of parafilm
-
Bekerglas
-
Lepel
-
Weegschaal
-
Weegschuitje
-
Maatcilinder
-
Mortier en stamper
-
Gedemineraliseerd water
-
2 g druivensuiker of glucose (C6H12O6)
-
75 ml natriumhydroxide 1 mol/l (NaOH)
-
2 ml indigokarmijnoplossing 1%
c.Bereiding oplossingen
Los 14 g glucose oplossing in 700ml water.
Los 6g NaOH op in 200 ml water tot een 3% oplossing.
d.Opstelling (foto)

e.Etiketten
3.Uitvoeren
a.Werkwijze
-
Maak een glucoseoplossing door 2 g druivensuiker op te lossen in 75 ml water.
-
Doe 2 ml indigokarmijn samen met de glucoseoplossing in een erlenmeyer.
-
Voeg 75 ml natriumhydroxide toe aan de glucoseoplossing.Doe de stop op de kolf.
-
Je kan de waarneming laten herhalen door krachtig te schudden met de erlenmeyer. Houd je vinger op de stop bij het schudden!
b.Waarneming (+ foto’s)
De kleur van de oplossing verandert meteen in groen, vervolgens na enige minuten in rood en na weer enige minuten tenslotte in geel. Daarmee is de proef niet voorbij, integendeel. Pak de kolf, houd een vinger op de stop zodat die er niet afvliegt, en schud krachtig. De oplossing wordt via rood weer groen. Zet de kolf neer en zie hoe de kleur weer overgaat in rood en daarna geel. Opnieuw schudden en alles gebeurt wederom. Dit kun je meerdere malen herhalen.

4.Reflecteren
Formule indigokarmijn: C16H8N2Na2O8S2
Glucose + O2 –> glucomaat
De indicator hier is indigokarmijn dat door de glucose omkeerbaar. Het indigokarmijn wordt gereduceerd van zijn basische groene vorm naar een gele, met als tussenstap een rode. Zuurstof uit de lucht oxideert de kleurstof weer terug van geel via rood naar groen.
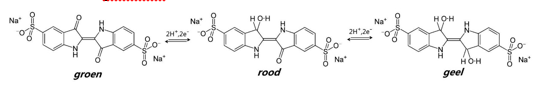
Het indigokarmijn wordt door de glucose reversibel gereduceerd van zijn basische groene vorm naar een gele, met als tussenstap een rode. Zuurstof uit de lucht oxideert de kleurstof weer terug van geel via rood naar groen.
De C=O groep (ketongroep) verandert in een C-OH groep (alcohol): een keton wordt tot een (secundaire) alcohol gereduceerd. De keton is de oxidator en neemt dus e¯ op:
R-CO + 2 H+ + 2 e¯ → R-HCOH
waarin R de onveranderlijke rest is van het molecuul.
De omzetting van glucose tot gluconzuur
Indigokarmijn zelf fungeert als zowel een pH- als redoxindicator. Onder pH 11.4 zien we de initiële blauwe kleur. Het heeft een gele vorm boven pH 13, maar bij een gemiddelde pH neemt het een groene tint aan. Naast de pH-afhankelijke kleuren zijn er drie verschillende redox-afhankelijke kleuren die het onderwerp zijn van de hoofddemonstratie. Herhaling van het experiment met 1 mol/l NaOH elimineert de groene kleur. In plaats daarvan gaat het van een gele naar een rode en vervolgens naar een gele verkleinde (die niet te onderscheiden is van de eerste gele kleur).
Onder alkalische omstandigheden wordt de glucose geïoniseerd en tautomeriseert tot het aldehyde met rechte keten en vervolgens tot het belangrijkste tussenproduct, een enediolaat anion.
Glucose + O2 –> glucomaat
Door de kolf te schudden wordt er zuurstof in de oplossing gebracht, die de kleurstof opnieuw tot de groene vorm reoxydeert, klaar om het proces te herhalen.






