Bont Geheimschrift
1.Onderzoeksvraag
We hebben een geheime boodschap gevonden die in verschillende kleuren verschijnt tijdens het ontcijferen met ijzertrichloride. Kan jij ons helpen te wie deze brief heeft geschreven? We denken dat dit ons naar de moordplaats en tot de dader kan leiden. Een aantal verdachten hebben een soortgelijke brief.
2.Voorbereiding
a. Begrippen
Ion: geladen deeltje
Ionenuitwisselingsreactie: een reactie tussen tegengesteld geladen ionen van twee elektrolyten in water.
Zout: ionverbindingen tussen één of meerdere metaal- of ammoniumionen en één of meerdere zuurrestionen.
Ionbinding: treedt op tussen metaalionen en niet-metaalionen.
b. Materialen
- Verstuiver
- Absorbeerbaar papier vb. koffiefilter
- Penseel of wattenstaafje
- 2 bekerglazen van 50ml
- Ammoniumthiocyanaat (NH4SCN) met een concentratie van 0,13mol/l
- Kaliumhexacyanoferraat (K4Fe(CN)6) met een concentratie van 0,08mol/l
- Gehydrateerd Ijzertrichloride (FeCl3. 6H2O) met een concentratie van 0,25mol/l
c. Opstelling

d. Veiligheid

3. Uitvoeren
a. Werkwijze
- Vul de verstuiver met ijzertrichloride.
- Doe een beetje kaliumhexacyanoferraat in een bekerglas. Doe dit ook met ammoniumthiocyanaat.
- Dompel je wattenstaafje onder in het kaliumhexacyanoferraat en schrijf een boodschap op de koffiefilter.
- Dompel nadien een ander wattenstaafje onder in ammoniumthiocyanaat en schrijf ook een boodschap op de koffiefilter.
- Laat de boodschappen drogen.
- Besprenkel de boodschappen met ijzertrichloride.
- Wat gebeurt er?
b. Waarneming
- Wanneer we de boodschappen geschreven hebben, zijn deze niet meer te lezen.
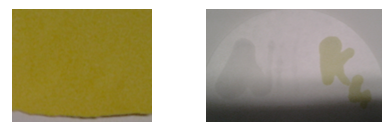
- Wanneer we het kaliumhexacyanoferraat besproeien met ijzertrichloride kunnen we de tekst terug lezen doordat deze blauw wordt.

- Wanneer we het ammoniumthiocyanaat besproeien met ijzertrichloride kunnen we de tekst terug lezen doordat deze geel- rood kleurt.

4.Reflecteren
a. Besluit
Tussen ijzertrichloride en kaliumhexacyanoferraat:
4Fe3+ + 3Fe(CN)64- –> Fe4(Fe(CN)6)3 blauw complex
Tussen ijzertrichloride en ammoniumthiocyanaat:
Fe3+ + SCN– –> FeSCN2+ rood complex
We kunnen de tekst dus in verschillende kleuren laten verschijnen afhankelijk van in welke stof de boodschap geschreven is.
Wanneer we ijzertrichloride over de koffiefilter sproeien, ontstaan er complexen. Deze gaan zorgen voor de kleur die ontstaat. Bij de reactie tussen ijzertrichloride en kaliumhexacyanoferraat ontstaat een blauw complex namelijk ijzerferrocyanide of beter bekend als Pruisisch blauw.
Pruisisch blauw is vooral bekend als een blauw pigment dat gebruikt wordt in verf en vroeger in blauwdrukken. Het staat bekend onder veel verschillende chemisch namen IJzer (III) ferrocyanide, ferri ferrocyanide, IJzer (III) hexacyanoferraat, en ferri hexacyanoferraat. Pruisisch blauw kan ook als complexvormer optreden en wordt soms gebruikt als antidotum bij vergiftigingsgevallen.
Het pure pigment , ook wel het eerste moderne pigment genoemd, is Parijs blauw en heeft een koperachtig rode schijn. Het is ontdekt in 1704 door de pigmentenmaker Johann Jacob Diesbach van Berlijn. Diesbach maakte het blauwe pigment per ongeluk terwijl hij aan het experimenteren was met het oxideren van ijzer en ossenbloed. Hij verwacht dat de kleur rood zou worden. Deze ontdekking was zeer gunstig voor kunstenaars omdat deze blauwe kleur goedkoop was.Het pigment werd in 1724 aan artiesten ter beschikking gesteld en is sinds die tijd zeer populair.
Pruisisch blauw wordt op commerciële schaal bereidt. Oorspronkelijk door de reactie van een ijzer(II) zout met kalium hexocyanoferrat. Het initiële witte product (Berlijns wit genaamd) werd daarna geoxideerd naar het blauwe pigment. Moderne methoden werken analoog maar gebruiken het goedkopere natriumferrocyanide. De oxidatie wordt uitgevoerd met natriumchloride, natriumchromaat, of andere reagentia.De vorming van Pruisisch blauw wordt gebruikt in aantoningsreacties, om ijzerionen aan te tonen. Kaliumferrocyanide geeft alleen met oplosbare ijzerzouten het blauwe neerslag. Deze reactie is ook zeer gevoelig.
Bij de reactie tussen ijzertrichloride en ammoniumthiocyanaat ontstaat een rood complex namelijk ijzerthiocyanaat. Er treedt hier een diffusiereactie op. Dit is een onderwerp dat de leerlingen eerder tijdens de lessen biologie gaan bestuderen. Toch kan je deze reactie uitleggen doordat twee ionen een slecht oplosbaar zout vormen dat gaat neerslaan.
b. Bronnen
5.Tips en Trics
Je kan de tekst met kaliumhexacyanoferraat best op een geel papier schrijven omdat de boodschap anders zichtbaar blijft. Dit komt doordat kaliumhexacyanoferraat een gele kleur heeft.
6.Vaststellingen
- In de omgeving van het lijk: Geheime boodschap die we moeten ontcijferen
- Verzamelde bewijsstukken: Geheime boodschap met eventueel verdere informatie
7.Verdachten

De geheime boodschap die zichtbaar wordt is: Neveg neteom raam dleg ej em dah ej
Oplossing: je had me je geld maar moeten geven.
De dader is: Linde
8.Werkblaadje
De geheime boodschap die zichtbaar wordt is:
Ontcijferd geeft dit:
OPM: je kan tips over de verdachte en de ontcijfering vinden op volgende link:
Besluit

Duid je hoofdverdachte aan.
- Astrid
- Linde
- Korneel
Waarneming
De geheime boodschap die zichtbaar wordt is:Neveg neteom raam dleg ej em dah ej
Ontcijferd geeft dit:Je had me je geld maar moeten geven.
OPM: je kan tips over de verdachte en de ontcijfering vinden op volgende link:






