Blauw en Oranje
Filmfragment
1.Onderzoeksvraag
Op welke manier katalyseren Cu(II)ionen de reactie tussen tartraat en zuurstofwater?
2.Voorbereiding
Materiaal + stoffen
- 1 Bekerglas 100 mL
- 1 Bekerglas 250 mL
- Roerstaaf of roerder
- verwarmingsplaat
- 110 ml ged. water (H2O)
- 0,1 g Koper(II)sulfaat (CuSO4•5H2O)
- 2,7 g Kaliumnatriumtartraat (KNaC4H4O6•4H2O)
- 5 ml Waterstofperoxide 30% (H2O2)
- 1 g Natriumcarbonaat (Na2CO3•nH2O)
- KI oplossing 0,1 mol/l
- CuSO4-oplossing 0,1 mol/l
- Verzadigde Na2S2O3 oplossing
Opstelling (foto)

3.Uitvoeren
a.Werkwijze
- Los in een bekerglas van 250 mL het seignettezout (KNa-tartraat) op in ca. 100 ml water (0,1 mol/L).
- Weeg het koper(II)sulfaat af. Maak in een bekerglaasje ca. 15 ml waterstofperoxide van ca. 10% klaar door 5 ml geconcentreerd waterstofperoxide te verdunnen met 10 ml water.
- Gedurende de proef wordt voortdurend geroerd!
- Verwarm de tartraatoplossing tot ca. 50° C. Voeg dan het koper(II)sulfaat toe.
- Als dat is opgelost, doe je er een druppeltje waterstofperoxide bij. De lichtblauwe oplossing wordt binnen een paar seconden troebel en oranje.
- Wanneer je nu een scheutje (een paar ml) waterstofperoxide toevoegt, verandert de kleur opnieuw: via groen wordt de suspensie weer helder en lichtblauw.
- Maar na enige tijd wordt het mengsel opnieuw oranje. Door zo steeds opnieuw wat peroxide toe te voegen, kan men dit proces enige malen herhalen.
- Als uiteindelijk het mengsel helder blauw blijft, kan men wat korreltjes soda toevoegen.
- De oplossing gaat schuimen en het veranderen van kleur wordt hervat
b.Waarneming (+ foto’s)
Na toevoegen van de waterstofperoxide wordt de lichtblauwe oplossing binnen een paar seconden troebel en oranje. Als we nog eens waterstofperoxide toevoegen, zal onze stof weer van kleur veranderen deze keer groen en weer oranje. Dit proces herhaalt zich elke keer weer.

4.Reflecteren
Het tartraat reduceert Cu2+ tot het rode Cu+. Vervolgens wordt het Cu+ door het waterstofperoxide terug geoxideerd. Een deel van het tartraat valt daarbij uiteen in koolzuurgas en mierenzuur. Met soda wordt het aldus ontstane al te zure milieu wat geneutraliseerd waardoor ook weer het koper actief kan worden.
Uiteindelijk oxideert het peroxide al het tartraat. Op het eind kan men ook zwart koper(II)oxide in de beker waarnemen. De temperatuur van de oplossing moet enigszins boven kamertemperatuur zijn, maar niet te hoog. Bij te lage temperatuur verloopt de oranjekleuring te traag of helemaal niet, en bij te hoge temperatuur gaat alles te snel: dan blijft het mengsel blauw.
Het toevoegen van steeds maar weer soda, Na2CO3, maakt de oplossing uiteindelijk basisch. In basische omgeving vormen koper(II)ionen het slecht oplosbare Cu(OH)2. Bij verhoogde temperatuur splitst dat water af en ontstaat het zwarte koper(II)oxide CuO:
Cu(OH)2 → CuO + H2O
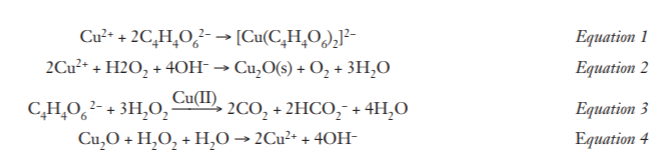
De omkeerbare oranje en blauwe reactie demonstreert verschillende fundamentele principes in de chemie. De katalytische ontleding van waterstofperoxide om zuurstofgas en water te produceren is bekend en vele stoffen, waaronder metalen en metaalionen, zullen de reactie katalyseren. De ontbindingsreactie is een voorbeeld van disproportionering waarbij waterstofperoxide zowel wordt geoxideerd, om zuurstofgas te geven, als gereduceerd, om water te geven.Waterstofperoxide kan daarom werken als reductiemiddel of als oxidatiemiddel, afhankelijk van de reactieomstandigheden en de substraten.De intens blauwe kleur waargenomen wanneer Cu (II) ionen worden toegevoegd aan de oplossing die waterstofperoxide en tartraationen bevat signaleert de vorming van koper (II) -tartraatcomplex-ionen (vergelijking 1). Wanneer de oplossing wordt verhit, katalyseren deze Cu (II) -ionen de ontleding van waterstofperoxide, resulterend in gasbellen en het vrijkomen van warmte. De gasbellen zijn een mengsel van zuurstof en koolstofdioxide, wat suggereert dat twee concurrerende redoxreacties gelijktijdig plaatsvinden. In één reactie, waterstofperoxide wordt geoxideerd door koper (II), waardoor zuurstofgas en een feloranje neerslag van koper (I) oxide worden verkregen (vergelijking 2). In een begeleidende reactie worden tartraationen geoxideerd door waterstofperoxide om kooldioxide, formiaationen en water te geven (Vergelijking 3). Cu (II) -ionen katalyseren deze reactie ook – de oxidatie van tartraat door waterstofperoxide verloopt langzaam in afwezigheid van een overgangsmetaalkatalysator. Het toevoegen van meer waterstofperoxide wanneer deze initiële reacties zijn verdwenen, oxideert koper opnieuw (I) oxide, resulterend in het verdwijnen van het oranje neerslag en de terugkeer van de blauwe kleur van de koper (II) complex-ionen (Vergelijking 4). De gehele cyclus herhaalt zich dan totdat de tartraationenconcentratie is uitgeput. Alle redox onderstaande vergelijkingen worden in de basisvorm geschreven, omdat bekend is dat de pH van het reactiemengsel tijdens het verloop toeneemt van de demonstratie.
5.Onderwerpen
- oscillerende reacties
- werking van een katalysator
6.Bron






