Bepaling van hoeveelheid CO2 in uitgeademde lucht door zuur
1.Onderzoeksvraag
Hoeveel CO2 bevindt er zich in uitgeademde lucht?
2.Voorbereiding
a.Begrippen als achtergrond voor experiment
- Fenolftaleïne kleurt (heeft zijn omslagpunt) bij pH 7
- CO2 is licht zuur
b.Materiaal + stoffen
- Buret
- Statief + klemmen
- Erlenmeyer 200 ml
- Rietje
- Fenolftaleïne
- Ca(OH)2 verzadigd
- HCl-oplossing 0,05M
c.Bereiding oplossingen
HCl geconcentreerd is ongeveer 12M: 1000ml x 0,05M = 12M x X
X = (1000ml x 0,05M ) / 12M
X= 4,16ml
4,16ml HCl conc. Oplossen met demi water tot 1liter => in maatkolf
d.Opstelling (foto)

e.Etiketten
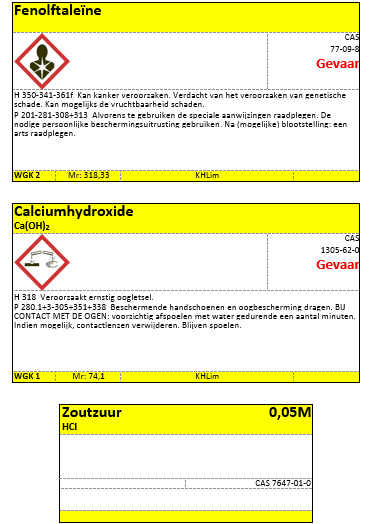
e.COS brochure
3.Uitvoeren
a.Werkwijze
- Vul de buret met 0,05 mol /l HCl.
- Doe wat Ca(OH)2 in de erlenmeyer samen met 3 druppels fenolftaleïne.
- Voer de titratie uit tot er een kleuromslag plaatsvindt.
- Noteer de hoeveelheid HCl die je hebt toegevoegd.
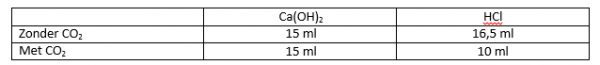
- Voer nu dezelfde titratie nog eens uit, maar voor je begint: blaas gedurende 60 sec in de erlenmeyer met Ca(OH)2 met het rietje.
- Noteer opnieuw de hoeveelheid HCl die je hebt toegevoegd.
b.Waarneming (+ foto’s)
Omdat we in het tweede deel van de proef hebben uitgeademd, hebben we al een deel zuur toegevoegd. Daardoor moeten we minder HCl toevoegen om tot neutralisatie te komen.Er zit 0,1625mmol CO2 in 60seconde uitgeademde lucht.

4.Reflecteren
a.Optredende reacties
2 HCl + Ca(OH)2 –> CaCl2 + 2 H2O
Ca(OH)2 + CO2 –> CaCO3 + H2O
CaCO3 + 2 HCl –> CaCl2 + CO2 + H2O
b.Besluit
1mol CO2 –> 2mol HCl
16,5ml – 10ml = 6,5ml 0,05M HCl-oplossing.
6,5ml 0,05mmol/ml = 0,325mmolHCl
0,1625mmol CO2
5. Aanvullingen
a.Koppeling aan leerplan/nen
b.Bronnen






