Ammoniumchloride verhitting
1.Onderzoeksvraag
Welk(e) gas(sen) ontstaan er als we ammoniumchloride verhitten?
2.Voorbereiding
a.Begrippen als achtergrond voor experiment
- Zuurtegraad pH = De waarde die bepaalt of een stof zuur, neutraal of basisch is. De pH wordt berekend met het aantal waterstofionen dat aanwezig is. Het wordt gemeten op een schaal van 0 tot 14, waarbij 7 voor `neutraal` staat. Wanneer de pH-waarde onder de 7 ligt, wijst dit erop dat een stof zuur is, pH-waarden boven 7 wijzen erop dat een stof basisch is.
- Vluchtig = vluchtige stoffen hebben een laag kookpunt, verdampen gemakkelijk en snel.
b.Materiaal + stoffen
- Proefbuis
- Glaswol
- Universeel Indicatorpapier
- Bunsenbrander
- Roerstaaf
- Proefbuisklem
- Ammoniumchloride
c.Opstelling (foto)

d.Etiketten

3.Uitvoeren
a.Werkwijze
- Doe 0,5 g ammoniumchloride in de proefbuis.
- Breng met een roerstaaf een stukje vochtig indicatorpapier voorzichtig in het onderste deel van de proefbuis en kleef hem aan de rand. Doe vervolgens een beetje glaswol in de proefbuis (midden van de proefbuis).
- Plak ook een stukje vochtig indicatorpapier aan de rand van de proefbuis in het bovenste deel.
- Verwarm de proefbuis boven de bunsenbrander.
b.Waarneming (+ foto’s)
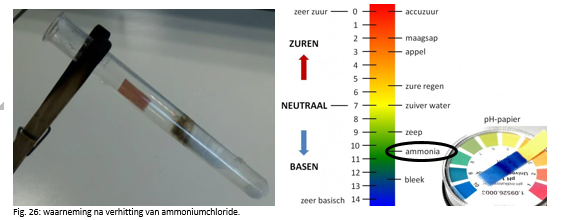
- Het indicatorpapiertje wordt eerst groen. (ammoniak wordt gevormd, is een base, is vluchtiger dan HCl)
- Na enkele seconden wordt het indicatorpapiertje donker oranje. (HCl wordt gevormd, is een zuur)
- We zien een neerslagvorming. (witte neerslag)
4.Reflecteren
NH4Cl –> HCl + NH3
Een deel van de ammoniumchloride reageert met de warmte die wij eraan hebben toegevoegd. Er wordt ammoniak (NH3) gevormd, lichter dan lucht. Dit gas stijgt in de reageerbuis en kleurt het indicatorpapier groen. De ammoniak verdwijnt na enkele seconde uit de buis. Na enige tijd verzamelt zich steeds meer waterstofchloride (HCl) in de buis, dit gas wordt ook gevormd door het verwarmen van ammoniumchloride. De neerslag die we kunnen zien in het proefbuisje is het gevormde waterstofchloride dat reageert met het nog aanwezige ammoniak en weer ammoniumchloride vormt. Daarna krijgt waterstofchloride de kans langs de rand van de buis te ontsnappen, waarbij het gas het indicatorpapier donker oranje kleurt.






