Evenwichtsconstante – Reactiequotiënt
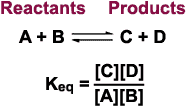
Definities
- evenwichtsconstante (K): De evenwichtsconstante geeft de verhouding weer van de snelheidsconstante van de heenreactie tot de terugreactie.
- reactiequotiënt (Q): Het reactiequotiënt van een evenwichtsreactie is de verhouding van het product van de concentraties van de reactieproducten tot het product van de concentraties van de reagentia. Hierbij verhef je elke concentratie tot een macht waarvan de exponent gelijk is aan de reactiecoëfficiënt.
- def evenwichtsconstante
- wikipedia evenwichtsconstante
Experimenten
- Bloedende snijwonde
- Kobaltchloride thermometer (niet uitvoeren in de klas wegens kobaltverbinding)
- Het evenwicht aantonen met een kobaltdichloride oplossing
- Ijzerevenwicht
- Koolstofdioxide/koolzuur evenwicht
- Magische kleurenwissel in een spuit
- Nauwkeurige thermometer
- Veranderende evenwichtsconcentraties
- Wet van Le Châtelier
- Hoe kunnen we het evenwicht koolzuur/koolstofdioxide beïnvloeden?
- Invloed van druk op het chemisch evenwicht
- Invloed van temperatuur op het chemisch evenwicht
Filmfragmenten
Lesvideo's youtube
- Evenwichtsconstante Film1 / Film2– reactiequotiënt
- oefeningen Film1 / Film2 / Film3
- Omzetting – omzettingsgraad – rendement
Eigen lesvideo's
Oefeningen lesvideo's
2. In een vat van 10,0 l bevindt zich 3,0 mol H2 , 4,5 mol I2 en 0,50 mol HI. Als er evenwicht is, geldt: H2(g) + I2(g) <–> 2 HI (g) met K= 46 . Bereken met de gegevens of er sprake is van een evenwicht
4. Noteer de evenwichtsconstante van de reactie: A + B <–> 2 C
7. In een reactievat met een volume van V=2,0 dm³ wordt 10 ml SO2 en 7 mol O2 gemengd. Men brengt het geheel op een temperatuur van T=1000 K en het volgende evenwicht stelt zich in: 2 SO2(g) + O2 (g) <–> 2 SO3 (g).
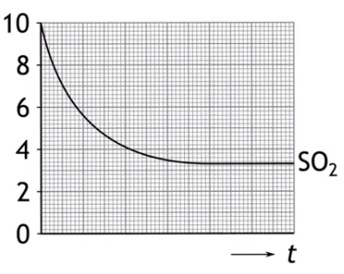
- Bereken de hoeveelheden van de drie stoffen bij evenwicht
- Teken nauwkeurig de lijnen van O2 en SO3 in de grafiek
- Bereken de evenwichtsconstante
8. Ammoniak kan worden gevormd uit stikstofgas en waterstofgas. Het gaat hierbij om een evenwichtsreactie: N2 + 3 H2 <–> 2 NH3 K= 0,20 . Men brengt in een vat van 3,0 dm³ de volgende stoffen bij een temperatuur van 500 K:
Laat met een berekening zien dat er geen sprake is van een evenwichtssituatie. Leg uit hoe de hoeveelheden veranderen als het evenwicht zich instelt. Nadat het evenwicht zich heeft ingesteld, heeft er 0,37 mol stikstofgas gereageerd. Laat zien dat er nu wel sprake is van een evenwichtssituatie.
9. In een buis bevindt zich een mengsel van NO2 en N2O4. Er heeft zich een evenwicht ingesteld: N2O4(g) <–> 2 NO2 (g)
- In de evenwichtstoestand bevat de buis evenveel mol N2O4 als NO2
- In een evenwichtstoestand vinden er geen reacties meer plaats in de buis.
10. Gegeven is het volgende gasevenwicht: N2O4(g) <-> 2 NO2(g) . Bij een bepaalde temperatuur is de waarde van de evenwichtsconstante 4,5. In 4 buizen bevinden zich bij deze temperatuur mengsels van NO2 en N2O4. Je bepaalt in elke buis de molariteiten van beide gassen.

11. In een reactievat van 1,0 l brengt men 0,75 mol N2O4(g) en 0,50 mol NO2(g). Na enige tijd heeft zich het volgende evenwicht ingesteld. N2O4 (g) <–> 2 NO2 (g). In het evenwichtsmengsel zit 0,40 mol O2. Hoeveel mol NO2 heeft gereageerd?
12. In een reactievat van 1,0 l brengt men 0,75 mol N2O4(g) en 0,50 mol NO2(g). Na enige tijd heeft zich het volgende evenwicht ingesteld. N2O4 (g) <–> 2 NO2 (g) .In het evenwichtsmengsel zit 0,40 mol O2. Bereken hoeveel mol N2O4 is ontstaan?
13. In een reactievat van 1,0 l brengt men 0,75 mol N2O4(g) en 0,50 mol NO2(g). Na enige tijd heeft zich het volgende evenwicht ingesteld.: N2O4 (g) ß> 2 NO2 (g) .In het evenwichtsmengsel zit 0,40 mol O2. Hoeveel mol NO2 heeft gereageerd? Hoeveel mol N2O4 is aanwezig in het evenwichtsmengsel?
14. In een reactievat van 1,0 l brengt men 0,75 mol N2O4(g) en 0,50 mol NO2(g). Na enige tijd heeft zich het volgende evenwicht ingesteld. N2O4 (g) <–> 2 NO2 (g). In het evenwichtsmengsel zit 0,40 mol O2. Bereken de waarde van de evenwichtsconstante bij de heersende temperatuur.
15. In een reactievat van 1,0 l brengt men 0,75 mol N2O4(g) en 0,50 mol NO2(g). Na enige tijd heeft zich het volgende evenwicht ingesteld. N2O4 (g) <–> 2 NO2 (g) .In het evenwichtsmengsel zit 0,40 mol O2. Hoeveel mol NO2 heeft gereageerd? Hoe groot is het rendement van de reactie in procenten?
16. In een afgesloten vat met een volume van 50 l wordt bij T°C zwaveldioxide en zuurstofgas gebracht. Het volgende gasevenwicht stelt zich in: 2 SO2(g) + O2(g) <–> 2 SO3(g). De waarden zijn op 4 verschillende tijdstippen weergegeven.
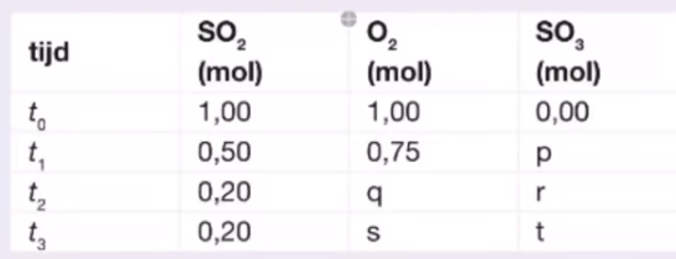
Wanneer is er evenwicht? Bereken wat er achtereenvolgens in de tabel moet worden ingevuld op de aangegeven plaatsen.
17. In een afgesloten vat met een volume van 50 l wordt bij T°C zwaveldioxide en zuurstofgas gebracht. Het volgende gasevenwicht stelt zich in: 2 SO2(g) + O2(g) <–> 2 SO3(g)

De waarden zijn op 4 verschillende tijdstippen weergegeven. Leg uit bij welk tijdstip het evenwicht heeft ingesteld.
18. In een afgesloten vat met een volume van 50 l wordt bij T°C zwaveldioxide en zuurstofgas gebracht. Het volgende gasevenwicht stelt zich in: 2 SO2(g) + O2(g) <–> 2 SO3(g)

De waarden zijn op 4 verschillende tijdstippen weergegeven. Geef de evenwichtsvoorwaarde voor het evenwicht
19. In een afgesloten vat met een volume van 50 l wordt bij T°C zwaveldioxide en zuurstofgas gebracht. Het volgende gasevenwicht stelt zich in: 2 SO2(g) + O2(g) <–> 2 SO3(g)

De waarden zijn op 4 verschillende tijdstippen weergegeven. Bereken de evenwichtsconstante voor dit evenwicht bij T°C.
Hoe veranderen deze snelheden wanneer nadien:
A: een positieve katalysator wordt toegevoegd
B: een extra hoeveelheid van een bepaald reagens wordt toegevoegd
C: een hoeveelheid van één bepaald reactieproduct wordt weggenomen?
Bereken de K-waarde, het rendement en de evenwichtsconcentratie van de vier gassen.
CO(g) + H2O(g) <–> CO2(g) + H2(g)
24. Voor het evenwicht: 2 IBr(g) <–> I2(g) + Br2(g) geldt bij 150°C; K: 8.5 10-3. Bereken de concentratie van IBr bij evenwicht, indien men initiëel 0.030 mol van deze stof in een volume van 1.0 l bracht. Hoe groot is de omzettingsgraad? Bereken de evenwichtsconstante van elk bestanddeel.
Evenwicht invloed van factoren
1. Men beschouwt het volgende evenwicht.: 2 A (g) + 4 B(g) <–> 3 C(g) + 4 D(s). De reactie naar rechts is exotherm.
- Geef de evenwichtsvoorwaarde
- Leg uit aan de hand van de Qc en K hoe het evenwicht verschuift als extra A wordt toegevoegd aan het evenwicht
- Leg uit aan de hand van de Qc en K hoe het evenwicht verschuift als extra C wordt toegevoegd aan het evenwicht
- Leg uit aan de hand van de Qc en K hoe het evenwicht verschuift als de druk wordt verkleind door het reactievat groter te maken
- Leg uit hoe het evenwicht verschuift als de temperatuur wordt verhoogd.
2. In een vat van 1,00 l bevindt zich 2,0 mol NO2 en 3,0 mol N2O4. Er is een evenwicht. Dit evenwicht wordt verstoord door 0,50 mol extra NO2 toe te voegen. Bereken [NO2] en [N2O4] van het nieuwe evenwicht.: 2 NO2 <–> N2O4
- Bereken K en de omzettingsgraad
- Bereken de nieuwe evenwichtsconcentraties en de nieuwe omzettingsgraad die zullen ontstaan als je vervolgens 0,3 mol HI wegneemt
- We halveren de druk. Wat zijn de evenwichtsconcentraties?
- Bij een andere temperatuur is K=3,05. Is de temperatuur gestegen of gedaald? Leg uit.
4. Naar welke kant verschuift het evenwicht bij deze reactie als de druk verhoogt?
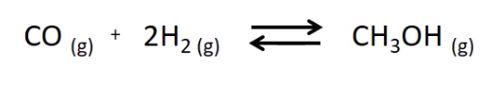
5.Gegeven zijn volgende evenwichtsreacties:
B: een katalysator wordt toegevoegd
C: het reactievolume wordt groter
E: het inerte gas argon wordt erbij geperst bij een constant volume
F: een extra hoeveelheid van de vermelde stof wordt eraan toegevoegd
G: een hoeveelheid van de vermelde stof wordt weggenomen
de concentratie van de vermelde stof wordt groter
Spellen
Quizzen
- Begrippen evenwichtsreacties
- De evenwichtsconstante
- Berekenen van de evenwichtsconstante
- Reactiequotiënt
- Verband tussen Q en K
- Oefening op rendement van evenwichtsreacties
- Oefeningen op omzetting bij evenwichtsreacties1
- Oefeningen op omzetting bij evenwichtsreacties2
- Evenwichtsconstante berekenen uit stofhoeveelheden
- Evenwichtsconstante berekenen via omzettingsgraad en stofhoeveelheden
- Berekenen van evenwichtsconcentraties1
- Berekenen van evenwichtsconcentraties2
- Berekenen van evenwichtsconcentraties3
Animaties
Ipad apps

De app geeft info over berekenen van concentraties en drukken van de reactanten en producten van de chemische reactie bij evenwicht. De toepassing leidt uiteindelijke evenwichtsparameters af op basis van evenwichtsconstanten (Kc en Kp), beginconcentraties en stoichiometrische coëfficiënten.
https://itunes.apple.com/be/app/chemical-equilibrium/id980553577?l=nl&mt=8
https://play.google.com/store/apps/details?id=com.androVR.chemicalequilibrium
Android apps
Evenwichtsreacties

De app geeft info over berekenen van concentraties en drukken van de reactanten en producten van de chemische reactie bij evenwicht. De toepassing leidt uiteindelijke evenwichtsparameters af op basis van evenwichtsconstanten (Kc en Kp), beginconcentraties en stoichiometrische coëfficiënten.
https://play.google.com/store/apps/details?id=com.androVR.chemicalequilibrium
Chemisch evenwicht

Definities, grafische voorstelling en factoren die een invloed hebben op het chemisch evenwicht
https://play.google.com/store/apps/details?id=wwk.wikikids.com.chemicalequilibrium&gl=BE
Inspiratie op het net
Evenwichtsconstante
- Wikiwijs definitie
- wikiwijs evenwichtsvoorwaarde
- wikiwijs waarden van K
- wikiwijs berekenen van evenwichtsconstante
- wetenschap begrip evenwichtsconstanteµ
- toelatingsexamen evenwichtsconstante
- internetboek evenwichtsconstante
- internetboek homogeen en heterogeen evenwicht
- internetboek extreme waarden van K
- internetboek Kc en Kp
- ugent evenwichtsconstante
- ugent combineren van reacties
- ugent uitdrukkingen van K
Concentratiebreuk
Evenwichtsreacties