Onderzoeksproject Ruimtelijke structuur van moleculen via modellen
1.Onderzoeksvraag
Hoe kun je met modellen chemische stoffen ruimtelijk voorstellen?
2.Voorbereiding
Voorbereiding
Molymod modelkit en Happy Atoms modelkit.
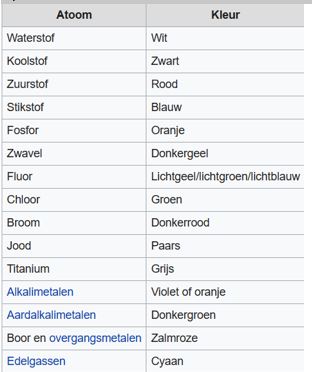
Opzoeken van de kleurencodes van de verschillende elementen.
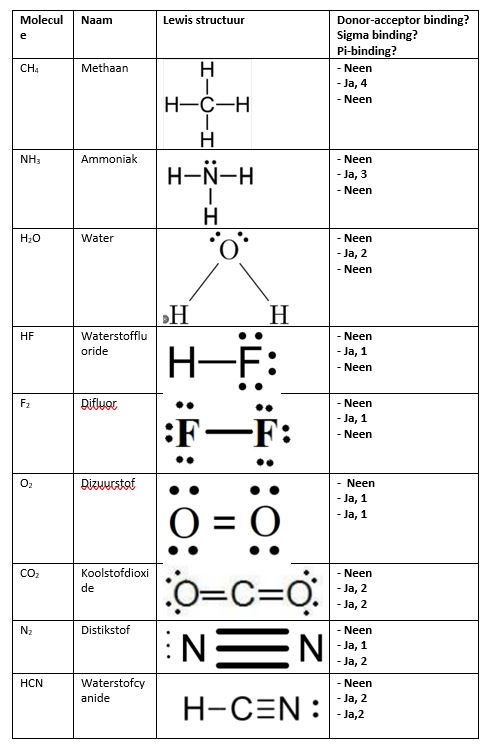
Nadenken over de naam, Lewis structuur, mogelijkheid van donor-acceptorbinding, aantal sigma bindingen en pi-bindingen van de verschillende moleculen.
Materialen
- Happy Atoms modelkit.
Dit model bevat verschillende atomen gaande van waterstof, zuurstof tot chloor. De atomen kan je met elkaar verbinden via magneten.
- Molymod modelkit.
Deze modelkit voor organische chemie is geschikt om koolwaterstoffen, alcoholen en carbonzuren te maken, maar ook om grotere moleculen zoals vitamine C. Het model bevat verschillende atomen met verschillende bindingshoeken. Er zijn directe verbindingen en korte vaste verbindingen met lange flexibele verbindingen.
De inhoud van de bouwdoos bevat 12 koolstofatomen, 20 waterstofatomen, 7 zuurstofatomen, 2 stikstofatomen, 1 zwavelatoom, 6 halogeen atomen en 64 verbindingsstukken van verschillende lengtes. De doos bevat ook een handige tool om verbindingen los te maken.
3.Uitvoeren



4.Reflecteren
Bij dit onderzoek werd gebruik gemaakt van twee modellen. Het bol-staaf model kon gebruikt worden om alle moleculen voor te stellen. Het andere model kon alle moleculen voorstellen behalve de laatste, N2O3. Hierbij is er een probleem bij het stikstofatoom (blauw) dat zowel een dubbele binding met het zuurstofatoom (rood) moet aangaan als een enkelvoudige binding met het zuurstofatoom en het stikstofatoom. Dit komt doordat dit stikstofatoom geen magnetische plaats meer heeft voor om met een zuurstofatoom een dubbele binding aan te gaan. Bijgevolg zou ik het bol-staaf model gebruiken om dit molecule voor te stellen.
De vrije elektronenparen zijn niet zichtbaar bij het bol-staafmodel, maar wel bij het andere model. Wanneer er dus voor een leerling de vrije elektronen zichtbaar gemaakt moeten worden, zou dit laatste model het beste model zijn. Hierbij moet wel op voorhand gecontroleerd worden of de bindingen aangegaan kunnen worden, dit is niet het geval bij N2O3.
De kleurencodes voor beide modellen zijn hetzelfde. Dit geldt ook zo voor andere modellen. Het is een universele code.
De gegeven moleculen bevatten geen datief-covalente bindingen. Maar als we bijvoorbeeld naar het molecule HClO2 zouden kijken, wat wel een datief-covalente binding bevat, dan zien we dat dit niet voorgesteld kan worden met de Molymod modelkit. De groene bolletjes bij het bol-staaf model, stellen het atoom chloor voor maar bevatten slecht 1 ‘gat’ om een verbinding te kunnen maken met een ander atoom. Hierdoor kan geen datief-covalente binding worden voorgesteld. Een oplossing voor dit probleem is het aankopen van een Molymod molecuulmodel kristalrooster NaCl. In deze kit bevatten de chloride-atomen wel meerdere ‘gaten’ om een datief-covalente binding voor te stellen. Bij het andere molecuulmodelkit is dit wel mogelijk, al steken hier de vrije elektronenparen van het zuurstofatoom wel wat uit.
Bij het bol-staaf model is er rotatie mogelijk bij volgende moleculen: H2CO3 en N2O3. Hier is er rotatie mogelijk rond de sigma binding van de binding tussen C en O enerzijds en N en N anderzijds. Bij de pi-bindingen is er geen rotatie mogelijk. Bij het andere model is het moeilijk om de rotatie te onderzoeken omdat dit werkt met magneten die gemakkelijk loskomen van elkaar.
Deze manier van werken verloopt goed. Door eerst de benaming, de Lewis structuur, de mogelijkheid op datief-covalente bindingen en het aantal sigma en pi-bindingen op te zoeken of zelf te achterhalen, kan je gemakkelijk de modellen maken.






