Eigenschappen van oxiden
- Onderzoeksvraag
Hoe kan een metaaloxide bereid worden?
Hoe kan je het gedrag van niet-metaaloxiden in water omschrijven?
Hoe kan je het gedrag van metaaloxiden in water omschrijven?
- Voorbereiding
Materiaal + stoffen
- o Magnesiumlint (ongeveer 2 cm)
o
 Kroesjestang
Kroesjestango Bunsenbrander
o Horlogeglas
o pH-kleurenpallet
· Materiaal:
o Rietje
o Twee proefbuizen
o Proefbuizenrekje
· Stoffen:
o Leidingwater
o Stof die we uitademen = …
o Broommethylblauw
· Materiaal
o Reageerbuis
o Proefbuizenrekje
o Horlogeglas
o Spatel
· Stoffen:
o Verbrandingsproduct van de eerste proef = magnesiumoxide (MgO)
o Fenolftaleïne
o Gedestilleerd water
Opstelling (foto)

- Uitvoeren
Werkwijze
- Neem allereerst een stukje magnesiumlint in de kroesjestang. Steek daarna de bunsenbrander (voorzichtig!) aan. Houd vervolgens het magnesiumlint in de vlam van de bunsenbrander tot het duidelijk brandt. OPGELET: Kijk niet te lang naar deze vlam zodra je het magnesiumlint erin houdt, want dat is niet goed voor de ogen! Laat het magnesiumlint nu verder verbranden boven het horlogeglas en vang het verbrandingsproduct op boven het horlogeglas.
Doe in de eerste proefbuis ongeveer 6 ml (gedestilleerd) water en een spatelpunt van de witte vaste stof. Voeg daarna 3 druppels fft toe en schud goed. Giet ongeveer de helft van de oplossing in een tweede proefbuis. Neem een rietje en blaas gedurende 1 minuut lucht in deze vloeistof. Kijk goed wat er gebeurt en noteer je waarnemingen!
Waarneming (+ foto’s)
Zodra je het stukje magnesiumlint in de vlam houdt, ontstaat er een fel wit licht.


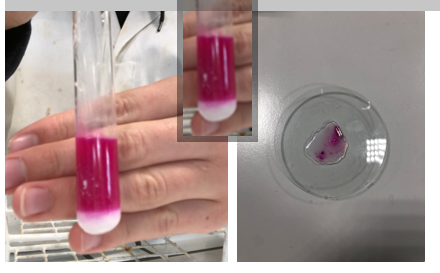
De kleur voor het blazen is paars. Dit betekent dat de pH-waarde is basisch.
Tijdens het blazen merk je geleidelijk aan een kleurverandering op. Dit betekent dat de pH-waarde is, dus er is een zure oplossing gevormd. Zuur van fenolftaleïne verandert van paars/roos naar kleurloos. Er is daarnaast ook een duidelijke neerslag te zien van de magnesiumoxide in het proefbuisje.
4.Reflecteren
Er treedt een verbrandingsreactie op tussen magnesium en dioxide. Het resultaat van de verbranding is magnesiumoxide.
Bijhorende reactievergelijking: 2Mg + O2 –> MgO![]()
Besluit: Metaaloxiden kunnen we bereiden door de verbranding van een metaal met een oxide. De algemene reactievergelijking hiervoor is de volgende: MgO + H2O –> Mg(OH)2
Er treedt een duidelijke kleurverandering op tussen de oplossingen in de twee proefbuizen.
Bij het blazen ontkleurt de paarse kleur.
Het uitgeblazen CO2 neutraliseert het Mg(OH)2:
Mg(OH)2 + CO2 –> MgCO3 + H2O






