Invloed van druk op het chemisch evenwicht
Filmfragment
1.Onderzoeksvraag
Welk effect heeft druk op een chemisch evenwicht?
2.Voorbereiding
- Spuit met dopje
- Spuitwater

3.Uitvoeren
a.Werkwijze
- Zuig een kleine hoeveelheid spuitwater op in de spuit.
- Plaats het dopje op de spuit.
- Trek de spuit uit en kijk wat er gebeurd met het water.
- Duw de spuit in en kijk wat er gebeurd met het water.
b.Waarneming (+ foto’s)


4.Reflecteren
Een stijging van de druk op een homogeen gasevenwicht veroorzaakt een daling van het volume van het gasmengsel. Daardoor verschuift de evenwichtstoestand naar die kant van de reactie waar het kleinste aantal gasmoleculen aanwezig is. Een daling van de druk op een homogeen gasevenwicht veroorzaakt een stijging van het volume van het gasmengsel. Daardoor verschuift de evenwichtstoestand naar die kant van de reactie waar het grootste aantal gasmoleculen aanwezig is.
Hoe kunnen we het CO2/H2CO3 evenwicht in water beïnvloeden?’
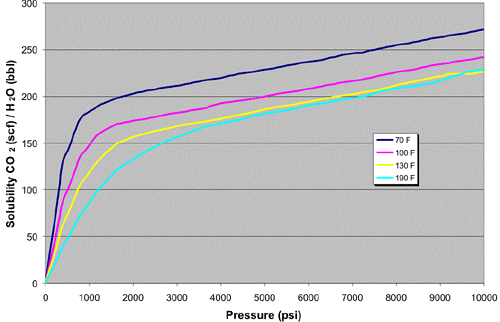
We kunnen dit beïnvloeden door gebruik te maken van druk. Deze factor zal invloed hebben op de oplosbaarheid van CO2 in de oplossing.
H2CO3 (aq) <–> H+ (aq) + HCO3– (aq)
HCO3– (aq) <–> H+ (aq) + CO32- (aq)
Le Châtelier
Door verhogen van de druk op een homogeen gasevenwicht neemt het volume af en daardoor nemen alle concentraties toe. Als het volume gehalveerd wordt bijvoorbeeld, verdubbelen alle concentraties.
Evenwicht tussen het opgeloste CO2 en H2CO3, koolzuur. :
CO2 (l) + H2O (l) <–> H2CO3 (l)
Deze reactie is kinetisch langzaam. Bij evenwicht wordt slechts een kleine fractie (ca. 0,2 – 1%) van de opgeloste CO2 daadwerkelijk omgezet in H2CO3. Het grootste deel van de CO2 blijft als gesolvateerde moleculaire CO2.
Als vergelijking:
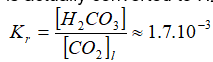
5.Onderwerpen
- evenwichtsreacties
- invloed van druk op een evenwichtsreactie
6.Bron






