Reductie van kaliumpermanganaat door suiker
FILMFRAGMENT
1.Onderzoeksvraag
Welke kleurveranderingen kan suiker veroorzaken bij de toevoeging aan kaliumpermanganaat?
2.Voorbereiding
a.Materiaal + stoffen
- Bekerglas 250 ml
- Roerstaaf
- Maatcilinder
- Petrischaal verdeeld in 4 stukjes
- 50 ml natriumhydroxide 1 mol/l (NaOH)
- 0,02 g kaliumpermanganaat (KMnO4)
- Glucose
- Maltose
- Zetmeel
- Gummibeertjes
b.Opstelling (foto)

3.Uitvoeren
a.Werkwijze
- Los 0,02 g kaliumpermanganaat op in 10 ml water.
- Voeg 50 ml natriumhydroxide in een bekerglas.
- Voeg 5 ml kaliumpermanganaat toe aan het bekerglas met natriumhydroxide.
- Meng de 2 oplossingen en giet vervolgens telkens een beetje van het mengsel in de 4 vakjes van het petrischaaltje.
- Leg in het eerste vakje van het petrischaaltje een gummibeer.
- Doe een spatelpuntje glucose in het tweede vakje.Doe een spatelpuntje maltose in het derde vakje.Doe een spatelpuntje zetmeel in het vierde vakje.
b.Waarneming (+ foto’s)

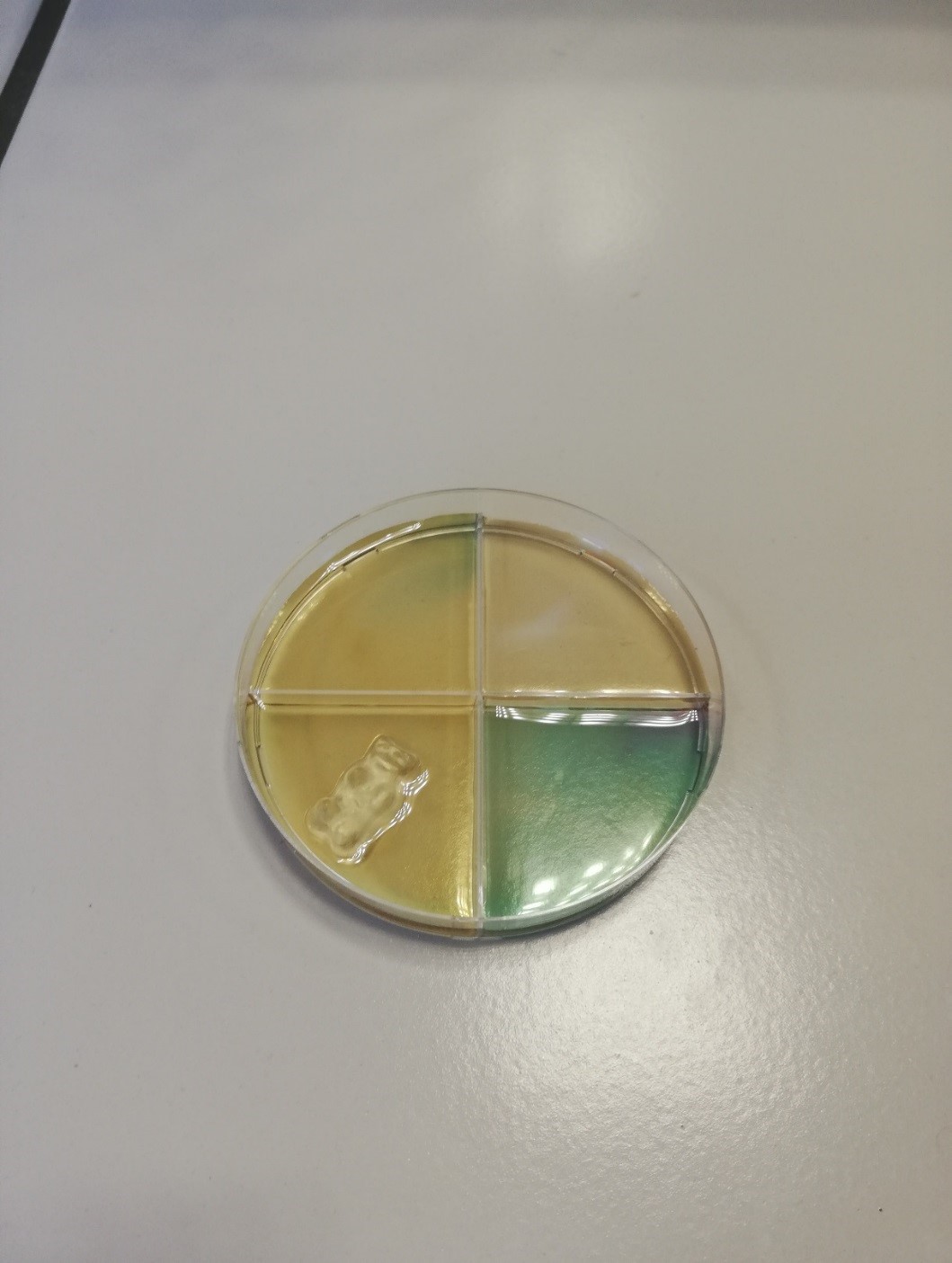
In het vakje met het gummibeertje neem je in het begin weinig waar. Daarna verkleurt de paarse vloeistof stllaan groen.
In het tweede vak kleurt het paarse kaliumpermanganaat meteen groen en daarna ook geel.
In het derde vak kleurt de oplossing in eerste instantie alleen groen, heel plaatselijk kleurt het na een tijdje ook een beetje geel. Dit duurt wel veel langer dan bij glucose.
In het vierde vak kleurt de oplossing alleen maar groen.
Als je het petrischaaltje lang genoeg laat staan, kleurt de oplossing in alle vakjes (uitgezonderd die met het zetmeel in) geel tot zelfs wit.
4.Reflecteren
Na enkele minuten wordt de oplossing achtereenvolgens diepgroen en daarna bruin gekleurd.
Onder invloed van NaOH zal het permanganaat met de suiker reageren. Wat overblijft is bruinsteen. Permanganaat is sterk paars en bruinsteen geel/bruin.
Omdat de reactie afhankelijk is van temperatuur en concentraties, zal de reactie in deze verhoudingen vrij langzaam verlopen. De kleurveranderingen zijn dan ook mooi te zien.
De laatste verandering, van groen naar geel en geel/bruin, duurt het langst. Die van paars naar donkerpaars gaat vrij snel.
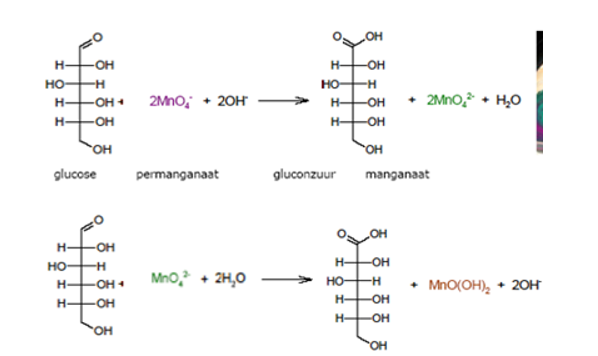
In KMnO4 is de oxidatietrap +VII. Dit geeft een paars zout. In alkalische omstandigheden en in aanwezigheid van suiker reduceert mangaan traag naar +VI (groen) en uiteindelijk naar +IV (geel). De reductie van +VII naar +VI gebeurt trager dan van +VI naar +IV.
Hier wordt het kaliumpermanganaat gereduceerd, wat betekent dat het elektronen wint, en de suiker wordt geoxideerd, wat betekent dat het wat verliest. Dit gebeurt in twee stappen.
In de eerste stap wordt het permanganaat-ion (het deel van het kaliumpermanganaat dat verandert) gereduceerd tot het manganaat-ion: MnO4– + e– → MnO42- . De verbinding aan de linkerkant is paars en de rechter aan de rechterkant is groen. Als deze reactie op gang komt, is er wat paars en wat groen in de oplossing en deze combineren om het er aan het begin blauw uit te laten zien.
Vervolgens wordt het groene mangaan opnieuw gereduceerd tot mangaandioxide:
MnO42- + 2H2O + 2 e– → MnO2 + 4OH–
Het mangaandioxide is een bruine vaste stof, maar het zit in zulke kleine deeltjes dat de vloeistof geel lijkt te worden.
Voor het suiker is de aanwezigheid noodzakelijk van een vrije aldehyde of ketonfunctie. Deze zijn voorzien in sucrose, maltose maar niet of zeer weinig in zetmeel. Hierdoor treedt er een kleurverandering op van het kaliumpermanganaat met de eerste twee suikers, maar niet met zetmeel.






