Effect van verdunde zuren en basen op indicatoren
1.Onderzoeksvraag
Tussen welke pH-waarde zit het omslaggebied van de zuur-base indicatoren?
2.Voorbereiding
a.Materiaal + stoffen
- Nunclonschaal (6op4)
- Pipetjes
- Proefbuis met proefbuisrekje
- Indicatoren:
- Broomthymolblauw
- Methyloranje
- Thymolftaleïne
- Buffer A pH 4: Citroenzuur 2,86 g en Boorzuur 3,1 g op 250 ml.
- Buffer B pH 9: NaHCO₃ en Na₂CO₃: Verhouding: NaHCO₃ 9x en Na₂CO₃ 1x
- Gedestilleerd water
- Zoutzuur (HCl) 0,1 mol/l
- Natriumhydroxide (NaOH) 0,1 mol/l
b.Opstelling (foto)

c.Etiketten

3.Uitvoeren
a.Werkwijze
Voorbereiding :
Neem 1 proefbuisje.
Neem alle indicatoren: broomthymolblauw, methyloranje, thymolftaleïne.
Doe in het proefbuisje 10 druppels broomthymolblauw , 5 druppels methyloranje en 5 druppels thymolftaleïne. Het proefbuisje noemen we het mengsel.
Uitvoering proef:
- Neem nunclonschaal en de pipetjes.
- Neem het mengsel uit de voorbereiding en alle indicatoren: broomthymolblauw, methyloranje, thymolftaleïne.
- Naast de indicatoren neem je ook buffer A, buffer B en de overige stoffen: zoutzuur, natriumhydroxide en gedestilleerd water.
- Neem alle stoffen met behulp van een pipet voor de 2 volgende stappen.
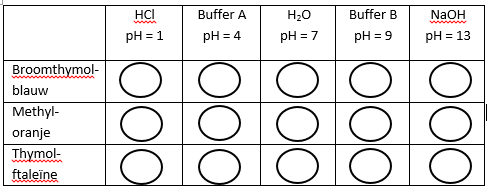
- Doe 2 druppels van alle indicatoren en 2 druppels van het mengsel in de nunclonschaaltjes. Doe dit voor alle horizontale rijen, zie hiervoor onderstaande tabellen.
- Neem de stoffen zoutzuur, buffer A, gedestilleerd water, buffer B en natriumhydroxide en voeg 2 druppels van de inhoud toe in de overeenstemmende nunclonschaaltjes. Doe dit voor de verticale kolommen, zie hiervoor onderstaande tabellen.
b.Waarneming (+ foto’s)
Broomthymolblauw en methyloranje zijn indicatoren die bij HCl en buffer A een andere kleur hebben dan hun oorspronkelijke kleur. Bij buffer B en NaOH zie je duidelijk dat ze hun eigen kleur hebben.
Broomthymolblauw heeft bij H₂O zijn oorspronkelijke kleur nog niet helemaal terwijl methyloranje wel al zijn oorspronkelijke kleur heeft bij H₂O.
Thymolftaleïne behoudt zijn oorspronkelijke kleur tot NaOH. Bij NaOH heeft Thymolftaleïne zijn oorspronkelijke kleur niet meer. Hier verkregen we een donkerblauwe kleur.

4.Reflecteren
Tussen welke pH-waarde zit het omslaggebied van de indicatoren?
Voor broomthymolblauw ligt de kleuromslag tussen buffer A, H₂O en buffer B. Bij buffer A heeft broomthymolblauw duidelijk nog een andere kleur. Bij H₂O heeft het bijna zijn originele kleur maar nog niet helemaal. Bij buffer B stellen we vast dat het duidelijk zijn originele kleur terug heeft. Het omslaggebied van broomthymolblauw zal rond de pH 7,1 liggen.
Voor methyloranje ligt de kleuromslag tussen buffer A en H₂O. Hier zal het kleuromslaggebied tussen de pH 4 en pH 7 liggen omdat het bij H₂O duidelijk zijn oorspronkelijke kleur terug heeft.
Voor thymolftaleïne ligt de kleuromslag tussen buffer B en NaOH. Bij buffer B heeft thymolftaleïne zijn oorspronkelijke kleur nog en bij NaOH zie je duidelijk dat de kleuromslag al gebeurd is. Hier zal het kleuromslaggebied dus tussen de pH 9 en pH 13 liggen.






