Diffusie van een gas via microschaal
1.Voorbereiding
a.Materiaal + stoffen
- twee reeksen nucleonschaaltjes
- geconc NH3
- HCl 1 mol/l
- KI 0,2 mol/l
- CuSO4 0,5 mol/l
- Zetmeeloplossing
- Bleekwater
b.Opstelling (foto)
2.Uitvoeren
a.Werkwijze
- Print de tabel af en bedek met een plastiek folie
- Breng in alle vierkanten van de linkse opstelling twee druppels CuSO4 behalve waar de cirkel staat
- Breng 1 druppel KI in elk vierkant van de rechter figuur en breng hierbij ook een druppel zetmeel, behalve waar de cirkel staat
- Snij het uiteinde van twee pipetten af om een klein darmpje te hebben wat op de twee uiteinden met cirkel wordt gezet.
- Breng 4 druppels ammoniak in het darmpje van de ene vezel en plaats vlug een deksel op de nucleon, welke niet aansluit.
- Voeg 2 druppels bleekwater en 2 druppels HCl in de andere darm en breng hierover vlug de deksel.
- Observeer
b.Waarneming (+ foto’s)
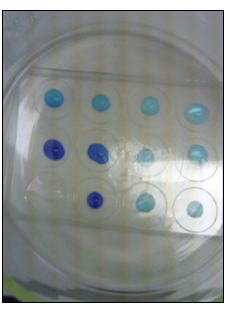
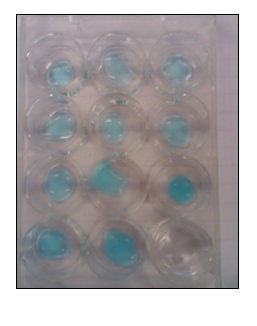
3.Reflecteren
In het ammoniakexperiment worden de druppels CuSO4 geleidelijk donkerder blauw door vorming van Cu(OH)2 en dan donker blauw door vorming van Cu(NH3)42+. De kleur verandert en er ontstaat een patroon. Er ontstaat dus geen gelijkmatige verdeling.
In het chloorexperiment vormen dijood met zetmeel zwarte complexen.
In beide experimenten is er een gradatie in kleurverandering afhankelijk van snelheid van diffusie van het gas.
De snelheid van diffusie is te vergelijken.
Ammoniak heeft een relatieve molecuulmassa van 17, dichloor van 71. De snelheid van beweging van geconcentreerd ammoniak en van chloor is verschillend. De snelheid komt overeen met de hypothese van Avogadro en met de Graham’s wet van gasdiffusie.






