Bruistablet
1.Onderzoeksvraag
Hoeveel CO2 komt er vrij bij het oplossen van een bruistablet ?
2.Voorbereiding
De meeste bruistabletten bevatten natriumwaterstofcarbonaat(NaHCO3), citroenzuur(C6H8O7) en salicylzuur(C7H6O3) . Het citroenzuur en het salicylzuur gaan optreden als H+ doneren, Het natriumwaterstofcarbonaat gaat zijn Na+ afgeven en deze H+ opnemen. Hierdoor ontstaat het zwakzuur diwaterstofcarbonaat. Dit gaat uiteen vallen in H2O en CO2.
a.Materiaal + stoffen
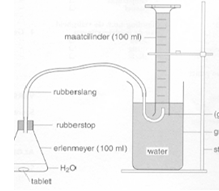
- Erlenmeyer met rubberen stop
- Maatcilinder
- Waterbad
- Rubberen slang
- Chronometer
- Bruistablet
- Gedemineraliseerd water
- Statief en klem
- Glazen buisje
- Balans
b.Opstelling (foto)
3.Uitvoeren
a.Werkwijze
- Maak een opstelling zoals aangegeven op de figuur.
- Bepaal de massa van het bruistablet.
- Giet 30ml gedemineraliseerd water in de erlenmeyer.
- Voeg het bruistablet toe en zet onmiddellijk de rubberen stop op de erlenmeyer, beweeg de erlenmeyer niet meer en start de chronometer.
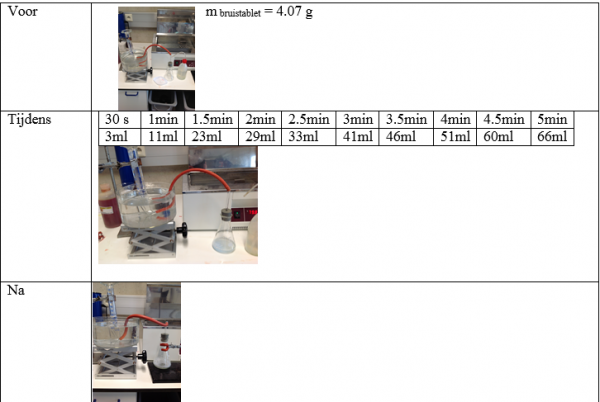
- Lees om de dertig seconden af hoeveel ml gas je hebt opgevangen en dit gedurende 5minuten.
b.Waarneming (+ foto’s)
4.Reflecteren
Bij het oplossen van een bruistablet van 4.07g komt er 66 ml CO2 vrij.






