Energieclassificatie reacties
1.Onderzoeksvraag
Kunnen we energie vormen en energie nodig hebben voor een chemische reactie?
2.Voorbereiding
a.Materiaal + stoffen
- CuSO4 watervrij (deel kopersulfaat verhitten om gehydrateerd water te verwijderen)
- NaHCO3
- Citroenzuur
- CuSO4 1 mol/l
- Zn-poeder
- NH4NO3
b.Opstelling (foto)

3.Uitvoeren
a.Werkwijze
- Breng in een proefbuis 5 ml water. Voeg hieraan 1 g watervrij kopersulfaat.
- Breng in een proefbuis 1 g NaHCO3 en 1 g citroenzuur. Voeg hieraan 2 ml water.
- Breng in een proefbuis CuSO4-oplossing 5 ml 1 mol/l. Voeg hieraan een spatelpunt zinkpoeder toe.
- Breng 10 ml water in een proefbuis. Voeg hieraan 2 g NH4NO3
b.Waarneming (+ foto’s)
Wat is de temperatuur van alle stoffen voor samenvoegen? ± 20°C
Wat gebeurt er wanneer we de stoffen samenvoegen?
a) De temperatuur stijgt lichtjes

CuSO4 + 5 H2O –> CuSO4.5H2O
b) Het mengsel begint te borrelen en koelt fel af.

NaHCO3 + H+ –> CO2 + H2O + Na+
c) De temperatuur stijgt lichtjes.

CuSO4(aq) + Zn(s) —> ZnSO4 + Cu(s)
De reactie is exotherm.
d) Het mengsel begint te borrelen en koelt af.
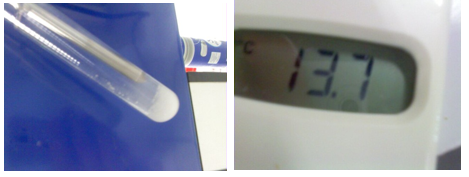
Het oplossen van NH4NO3 in water is een endotherm proces
4.Reflecteren
Wanneer we de stoffen samenbrengen, begint een chemische reactie.
Welke energieomzetting vindt plaats tijdens de chemische reactie?
Chemische energie wordt omgezet in warmte-energie.
In een endo-energetisch proces kan een chemische reactie optreden door toevoeging van warmte.
In een exo-energetisch proces kan een chemische reactie optreden met afgifte van warmte.
5. Aanvullingen
Voor het bevochtigen van kopersulfaat
Gehydrateerd kopersulfaat wordt wit en het krijgt een poedervorm na het verwarmen. Tijdens het verwarmen ontstaat condens. Het verkregen wit poeder is watervrij kopersulfaat.
Bij het toevoegen van water komt warmte vrij.
verhitten
CuSO4.5H2O –> CuSO4 + 5 H2O
Blauw wit
Voor reactie tussen bakpoeder en citroenzuur
-Maak gebruik van een klein maatbekertje (maximum 100 ml).
-Als alternatief voor citroenzuur kun je wijnsteenzuur gebruiken. Als citroenzuur kun je ook de inhoud van zure hosties gebruiken. De temperatuurverandering is hierbij beperkt.
-Citroenzuur wordt vaak verkocht als ontkalkingsmiddel.
-Een paar milliliter water volstaat om de reactie te starten.
-Eventueel kun je ook roeren met de sonde van een digitale thermometer.
Voor het oplossen van ammoniumnitraat
Oplossingsenthalpiewaarden ΔH in kJ/mol
Hotpacks: CaCl2(s) = -81.3 kJ/mol
MgSO4(s): -91.2 kJ/mol
Coldpack: NH4NO3: 25,7 kJ/mol
De exacte enthalpiewaarde voor een gegeven staal is het resultaat van 3 soorten interacties:
-solvent-solventinteractie: energie nodig om de intermoleculaire interacties tussen de solventmoleculen te overwinnen :negatieve enthalpie
-roosterinteracties:de energie die nodig is om de krachten :ionenroosterkrachten voor ionbinding of intermoleculaire krachten tussen moleculen in een atoombinding te overwinnen: negatieve enthalpie
-hydratatieenergie: de energie die vrijkomt wanneer de solvent moleculen zich rond de individuele partikels positioneren: positieve enthalpie
Bronnen






