De brandstofcelauto
1.Onderzoeksvraag
Waarom kan een auto rijden op waterstofgas?
2.Voorbereiding
a.Begrippen als achtergrond voor experiment
- Elektrolyse is een chemische reactie waarbij onder invloed van een elektrische stroom samengestelde stoffen worden ontleed tot enkelvoudige stoffen en-of andere samengestelde stoffen.
- Een endo-energetische reactie is een reactie waarbij er energie wordt opgenomen.
- Een exo-energetische reactie is een reactie waarbij er energie wordt afgegeven.
- Een redoxreactie of elektronenuitwisselingsreactie is een reactie waarbij het oxidatiegetal van een atoom toeneemt en het oxidatiegetal van een ander atoom afneemt
b.Materiaal + stoffen
- Waterstofauto
- Energiebron
- Klein spuitje
- 2 Volt-meters
- Ampère-meter
- Motor
- Lampje
- Kleine versie van het toestel van Hoffman
- brandstofcel
- Voldoende kabeltjes
- gedemineraliseerd water
c.Opstelling (foto)


3.Uitvoeren
a.Werkwijze







b.Waarneming (+ foto’s)


4.Reflecteren
Deel 1+2:
2 H2O + energie → 2 H2 + O2↑ endo-energetische reactie
Anode: H2 → 2 H+ + 2 e–
Kathode: O2 + 4 H+ + 4 e– → 2 H2O
Gehele cel: 2 H2 + O2↑ → 2 H2O + energie exo-energetische reactie
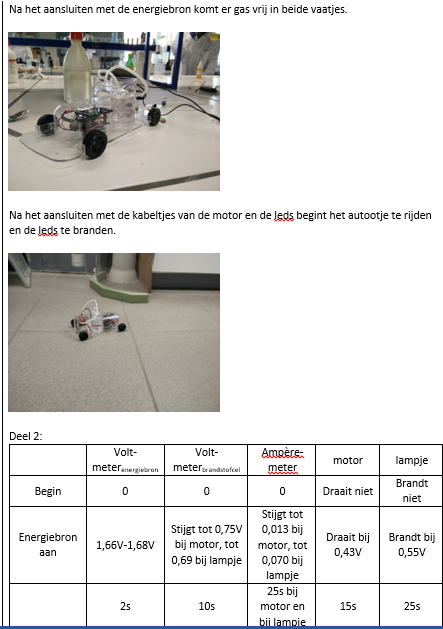
Wanneer we de energiebron op het autootje aansluiten, ontstaat er een chemische reactie met het water. Het water splitst zich namelijk op in waterstofgas in het ene vaatje en zuurstofgas in het andere vaatje.
Als we vervolgens de kabeltjes van de motor en de leds op de auto aansluiten, worden het waterstofgas en het zuurstofgas afzonderlijk van elkaar aan de brandstofcel toegevoerd. Het waterstofgas ontstaat bij de anode en het zuurstofgas bij de kathode. In de cel blijven beide gassen van elkaar gescheiden door een membraan. Het waterstofgas aan de anode wordt met behulp van een katalysator gesplitst in twee H+-ionen en twee elektronen. De elektronen stromen vervolgens via een elektrisch circuit naar de kathode. De waterstofionen doen dit door de elektrolyt. De elektronen en de waterstofionen verenigen bij de kathode. Hier vindt er een reactie plaats met het zuurstofgas die bij de kathode wordt ingevoerd. Er ontstaat water.
Gedurende dit chemisch proces wordt er energie geleverd. In theorie komt het per cel ongeveer overeen met 1,2 volt. In de praktijk ligt het eerder in de buurt van 0,5 tot 0,8 volt. Om de spanning te verhogen, worden de afzonderlijke cellen op elkaar gestapeld en in serie geschakeld.


Het autootje rijdt wanneer het niet is aangesloten op een energiebron. Het rijdt op de baterij die we opgeladen hebben met behulp van een energiebron. Die zie je ook aan de motor en het lampje in het tweede deel. Eens de energiebron is uitgeschakeld blijft de motor draaien en het lampje branden tot de energie in de batterij op is.






