Elektrolyse van kopersulfaat
Filmfragment
1.Onderzoeksvraag
Wat gebeurt er bij de elektrolyse van een kopersulfaatoplossing?
2.Voorbereiding
a.Begrippen als achtergrond voor experiment
- Elektrolyse: Elektrolyse is een proces waarbij met een externe spanningsbron een niet-spontane redoxreactie optreedt.
- Endo-energetische reactie: Een endo-energetische reactie is een reactie waarbij energie wordt opgenomen.
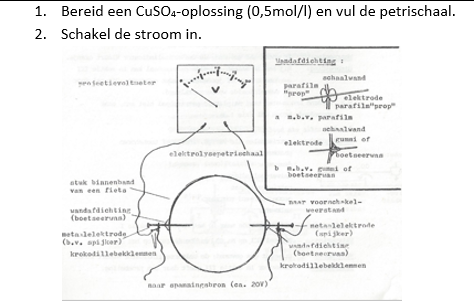
b.Materiaal + stoffen
- Petrischaal met metaalelektroden
- Spanningsbron ca. 20V
- Snoertjes met krokodillenklemmen
- Spatel
- Elektroden van koperdraad en koolstof (potloodstift)
- Kopersulfaat 0,5mol/l
c.Bereiding oplossingen
- Kopersulfaat 0,5mol/l
c= 0,5 mol/l M= 249,68 g/mol V= 0,25l
Gevraagd: m
Oplossing:
n=c.V = 0,5 mol/l . 0,25l = 0,125 mol
m= n . m = 0,125 mol . 249,68 g/mol = 31,21 g
d.Opstelling (foto)

e.Etiketten

3.Uitvoeren
a.Werkwijze
b.Waarneming (+ foto’s)

4.Reflecteren
Bij grafietelektroden:
Kathode: 2Cu2+ + 4e– –> 2Cu
Anode: 2H2O –> O2 + 4H+ + 4e–
netto reactie: 2 Cu2++ 2H2O –> 2Cu + 4H+ + O2
Bij koperelektroden:
Kathode: Cu2+ + 2e– –> Cu
Anode: Cu –> Cu2+ + 2e–
Grafietelektroden:
De negatieve grafietelektrode trekt Cu2+ ionen (van kopersulfaat) aan. Aan de positieve grafietanode wordt zuurstofgas gevormd door oxidatie van de hydroxide ionen die zich in de kopersulfaatoplossing bevinden.
Koperelektroden:
Het bruine neerslag aan de negatieve pool wordt gevormd komt doordat daar elektronen worden weggetrokken en de koperelektroden positief geladen worden. Hierdoor gaat de koperionen zich afzetten en vormt er een bruine neerslag. Aan de positieve pool worden er elektronen opgenomen en gaan de koperionen zich aan de koperelektrode vastmaken.
De bruine neerslag aan de negatieve pool wordt gevormd door een laagje vast koper. De sterkste oxidator in de oplossing nl. Cu2+ neemt elektronen op aan de negatieve pool. Bij de positieve pool ontstaan belletjes zuurstofgas. De sterkste reductor in de oplossing, nl. water, staat aan de positieve pool elektronen af.
De negatieve sulfaationen (SO42-) of de sporen van hydroxide-ionen (OH–) worden aangetrokken door de positieve elektrode. Maar het sulfaation is te stabiel en er gebeurt niets. In plaats daarvan worden ofwel hydroxide-ionen of watermoleculen afgevoerd en geoxideerd om zuurstof te vormen.
5.Onderwerpen
- elektrolyse
- onderscheid tussen een elektrolyse en een galvanische cel
6.Bron






