Aluminium, lucht en een batterij
1.Onderzoeksvraag
Hoe kunnen we een batterij bouwen met aluminium?
2.Voorbereiding
Materiaal + stoffen
- Koperen plaatje
- Aluminium plaatje
- Demi-water
- Zout
- Bleek (Chloor)
- Kabels met krokodillenklem
Opstelling (foto)

3.Uitvoeren
a.Werkwijze
- Buig een kant van de metalen plaatjes dusdanig dat ze makkelijker over het potje heen passen en er makkelijker een krokodillenklem aan te bevestigen is.
- Plaats de elektroden in de beker.
- Bevestig de meetkabels aan de elektrodes (+ Cu, – Al).
- Start de meting.
- Voeg water toe aan de beker.
- Wacht enige tijd en voeg een spatelpuntje zout toe en roer.
- Wacht weer enige tijd en voeg wat bleek toe.
b.Waarneming (+ foto’s)

4.Reflecteren
Meestal gebruikt men koper en zink in een batterij, in dit experiment hebben we gebruik gemaakt van koper en aluminium. De standaardpotentiaal voor koper en aluminium half-cel reacties die dan gebruikt worden zijn:
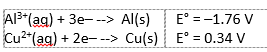
Het in water opgeloste zuurstof wordt door deze elektronen gereduceerd volgens:
| O2 (aq) + 2H2O (aq) + 4e– –> 4OH– (aq) | E° = 0.82 V |
Aan de anode wordt het Aluminium geoxideerd volgens:
| Al (s) + 3OH– (aq) –> Al(OH)3 (s) | E° = 2.30 V |
Het aluminium hydroxide dat gevormd wordt vormt een wit neerslag op de elektrode.






