De reactie van metalen met zuren
1.Onderzoeksvraag
Hoe reageren verschillende metalen met verschillende zuren?
2.Voorbereiding
Materiaal + stoffen
- geplastificeerd papier
- pipetten
- HCl 1mol/l
- HNO3 1 mol/l
- HNO3 5 mol/l
- H2SO4 1 mol/l
- Mg lint
- Zn korrels
- Fe poeder
- Sn korrels/poeder
- Koperdraad/poeder
Bereiding oplossingen
1 M HCl:
- 1 M = 1 mol /l
- Molecuulmassa van zoutzuur is 36,5 g/mol
- 1 . 36,5 = 36,5 gram HCl per liter bevat je oplossing.
- Mits geconcentreerd zoutzuur 37% is: 36,5 . (100/37) = 98,6 gram.
Dit is de hoeveelheid die je dient af te wegen.
- Omdat de dichtheid 1,19 g/ cm3 is, weten we dat je ook gewoon 82,3 ml kan afmeten en toevoegen aan 1l water.
1M HNO3 (idem voor 5M):
- 1M = 1 mol /l
- Molecuulmassa van salpeterzuur is 63 g/mol
- 1 . 63 = 63 gram HNO3 per liter bevat je oplossing.
- Mits geconcentreerd salpeterzuur 98% is: 63 . (100/98) = 64,286 gram.
Dit is de hoeveelheid die je dient af te wegen.
- Omdat de dichtheid 1,6 g/ cm3 is, weten we dat je ook gewoon 40,18 ml kan afmeten en toevoegen aan 1l water.
1M H2SO4:
- 1M = 1 mol /l
- Molecuulmassa van zwavelzuur is 98,08 g/mol
- 1 . 98,08 = 98,08 gram HNO3 per liter bevat je oplossing.
- Mits geconcentreerd salpeterzuur 98% is: 98,08 . (100/98) = 100,08 gram.
Dit is de hoeveelheid die je dient af te wegen.
- Omdat de dichtheid 1,94 g/ cm3 is, weten we dat je ook gewoon 51,6 ml kan afmeten en toevoegen aan 1l water.
Opstelling (foto)
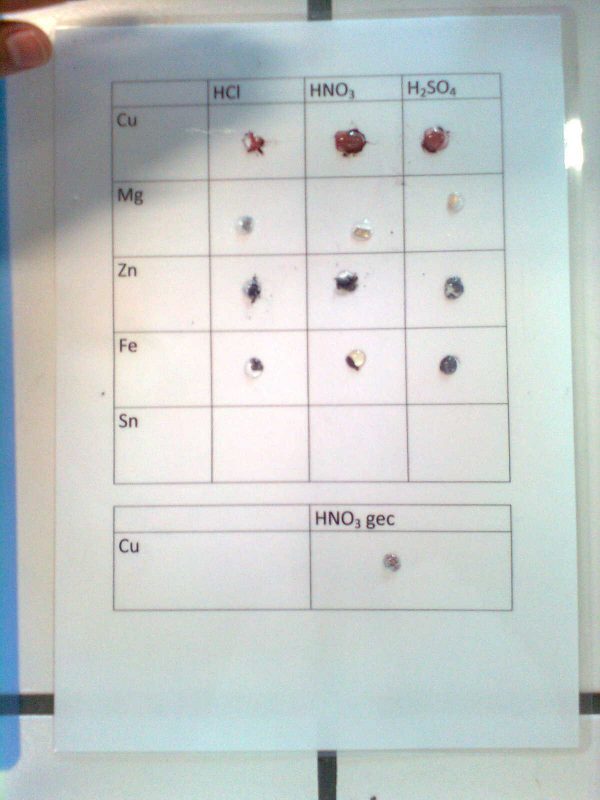
3.Uitvoeren
a.Werkwijze
- Maak bijhorend blad en plastificeer.
- Leg wat koperpoeder of draad in de koperrij.
- Leg telkens een klein stukje Mg draad in de Mg-rij.
- Leg telkens wat zinkgranulen in de Zn-rij.
- Leg telkens wat ijzerpoeder in de Fe-rij.
- Leg telkens wat tinpoeder of –granulen in de Sn-rij.
- Voeg nu in de HCl kolom telkens 2 druppels verdunde HCl.
- Voeg in de H2SO4 rij telkens 2 druppels H2SO4.
- Voeg in de HNO3 kolom telkens 2 druppels verdunde HNO3.
- Leg in de laatste box een klein stukje koper en voeg hieraan 2 druppels geconcentreerd HNO3.
b.Waarneming (+ foto’s)
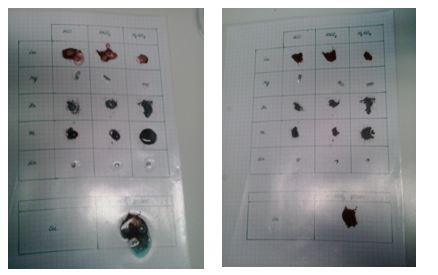
4.Reflecteren
De pKa-waarden geven ons meer info over de sterkte van de zuren. We kunnen hieruit besluiten dat HCl een sterker zuur is dan zwavelzuur en dat dit op zijn beurt een sterker zuur is dan salpeterzuur.Een tweede besluit die we uit deze proef zouden kunnen trekken is de spanningsreeks der metalen.
We zien dat Mg, Zn, Fe en Sn reageren met de verdunde zuren. Terwijl Cu dit niet doet.
Koper is niet in staat om waterstofionen (uit het zuur) te reduceren. Vandaar dat er geen reactie optreedt. We kunnen dus zeggen dat H2 een sterkere reductor is dan Cu.
Wanneer we bijvoorbeeld Mg-stukjes laten reageren met de zuren, zien we een bruisende reactie optreden. Hieruit kunnen we opmaken dat H2-gas gevormd wordt. Dus Mg is in staat om de waterstofionen te reduceren.
Vandaar dat we de volgende spanningsreeks kunnen opstellen:
Mg > H > Cu
Dit kunnen we doen voor elk de metalen:
Mg, Zn, Sn, Fe > H > Cu.
Als je wil weten welk van de metalen link de grootste reductor is, zal je onderlinge proeven moeten uitvoeren.
Cu + 2HCl –> CuCl2 + H2
3Cu + 8 HNO3 (verdund) –> 3 Cu(NO3)2 + 2 NO + 4 H2O
Cu + H2SO4 –> CuSO4 + H2
Cu + 4 HNO3 (geconc.) –> Cu(NO3)2 + 2 NO2 + 2 H2O
Mg + 2HCl –> MgCl2 + H2
Mg + 2HNO3 –> Mg(NO3)2 + H2
Mg + H2SO4 –> MgSO4 + H2
Zn + 2HCl –> ZnCl2 + H2
Zn + 2HNO3 –> Zn(NO3)2 + H2
Zn + H2SO4–> ZnSO4 + H2
Fe + 2HCl –> FeCl2 + H2
Fe + 4HNO3 –>Fe(NO3)3 + H2O + NO
2Fe + 3H2SO4 –> Fe2(SO4)3 + 3H2
Sn + 2HCl –> SnCl2 + H2
Sn + 4HNO3–> SnO2 + 2H2O + 4NO2
Sn + 2H2SO4–> SnSO4 + 2H2O + SO2






