Verdunde en geconcentreerde zuren reageren verscheiden
1.Onderzoeksvraag
Wat neem je anders waar als je zink laat reageren met verdunde en geconcentreerde zuren?
2.Voorbereiding
Materiaal + stoffen
- Zinkpoeder
- Geconcentreerd zwavelzuur en salpeterzuur
- H2SO4 1 mol/l en HNO3 1 mol/l
Bereiding oplossingen
1M HNO3:
- 1M = 1 mol /l
- Molecuulmassa van salpeterzuur is 63 g/mol
- 1 . 63 = 63 gram HNO3 per liter bevat je oplossing.
- Mits geconcentreerd salpeterzuur 98% is: 63 . (100/98) = 64,286 gram.
Dit is de hoeveelheid die je dient af te wegen.
- Omdat de dichtheid 1,6 g/ cm3 is, weten we dat je ook gewoon 40,18 ml kan afmeten en toevoegen aan 1l water.
1M H2SO4:
- 1M = 1 mol /l
- Molecuulmassa van zwavelzuur is 98,08 g/mol
- 1 . 98,08 = 98,08 gram HNO3 per liter bevat je oplossing.
- Mits geconcentreerd salpeterzuur 98% is: 98,08 . (100/98) = 100,08 gram.
Dit is de hoeveelheid die je dient af te wegen.
- Omdat de dichtheid 1,94 g/ cm3 is, weten we dat je ook gewoon 51,6 ml kan afmeten en toevoegen aan 1l water.
Opstelling (foto)
3.Uitvoeren
a.Werkwijze
- Breng in 4 proefbuizen respectievelijk 1 ml gec. H2SO4, geconcentreerd HNO3, verdunde H2SO4 en verdunde HNO3.
- Laat in alle vier proefbuizen een spatelpunt zink vallen.
- Vergelijk de reactiviteit
b.Waarneming (+ foto’s)

4.Reflecteren
De reactie tussen zink en verdund zwavelzuur zorgt voor de vorming van een witte stof en een gas. Deze reactie is licht bruisend.
Bij geconcentreerd zwavelzuur is de reactie heviger. Er ontstaat een schuimlaag dankzij de productie van het gas.
Voor salpeterzuur geldt hetzelfde. Hoe sterker de concentratie, hoe heviger de reactie.
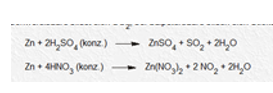
Zn + H2SO4 –> ZnSO4 + H2
Zn + HNO3 –> Zn(NO3)2 + H2
5. Aanvullingen
- Je kan de proef doen met een koperen munt in salpeterzuur.
- Je kan best handschoenen aandoen bij het uitvoeren van deze proeven.
Bronnen






