Aantonen van CO2 met kalkwater
1.Onderzoeksvraag
Wat gebeurt er als we eiwit laten reageren met HCl, HNO3 en H2SO4?
2.Voorbereiding
a.Begrippen als achtergrond voor experiment
- neerslag
- troebel
b.Materiaal + stoffen
- eiwit van rauw ei
- 6 mol/l HCl
- HNO3 10 mol/l
- H2SO4 geconcentreerd
c.Bereiding oplossingen
6 M HCl:
m = n . M = 6 . (2.1 + 32 + 4.16) = 6. 98 = 588 g.
Dus als je 588 g zwavelzuur in 1 liter water oplost, bekom je 6M HCl.
10M HNO3:
- 10M = 10 mol /l
- Molecuulmassa van salpeterzuur is 63 g/mol
- 10 . 63 = 630 gram HNO3 per liter bevat je oplossing.
- Mits geconcentreerd salpeterzuur 98% is: 630 . (100/98) = 642,86 gram.
Dit is de hoeveelheid die je dient af te wegen.
- Omdat de dichtheid 1,6 g/ cm3 is, weten we dat je ook gewoon 401, 8 ml kan afmeten en toevoegen aan 1l water.
d.Opstelling (foto)
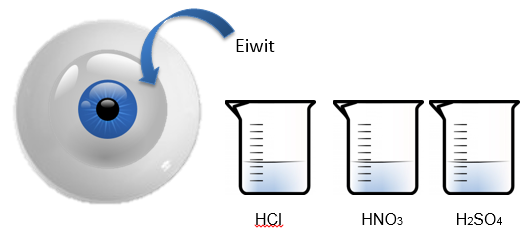
3.Uitvoeren
a.Werkwijze
- Teken een groot oog op de bodem van een petriplaat, plaats dit op een overhead projecter en breng eiwit in de petrischaal.
- Laat nu een paar druppels geconcentreerd HCl vallen op het “oog”.
- De oplossing wordt troebel.
- Doe het zelfde met de H2SO4 en de HNO3
- Neem het verschil waar.
b.Waarneming (+ foto’s)


4.Reflecteren
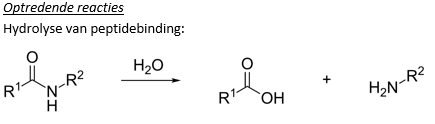
We zien dat het gebruik van sterke zuren zorgt voor chemische reacties zoals neerslagvorming (eiwit + HCl). Dit is een irreversibel proces omdat de sterke zuren zorgen voor een hydrolyse van de peptidebindingen tussen de aminozuren. Wat betekent dat de eiwitten als het ware uiteen vallen. Dit noemen we denaturatie van het eiwit!
Mits zowel zoutzuur, zwavelzuur als salpeterzuur sterke zuren zijn, geldt de denaturatie van het eiwit voor ze alle drie!
Onder invloed van de geconcentreerde zuren treedt coagulatie op. In geval van zwavelzuur treedt ook verkoling op.
5. Aanvullingen
Hoe schadelijk zijn sterke zuren voor ons oog?
In het oog, achter de pupil, bevindt zich een ooglens. Deze bestaat voornamelijk uit eiwitten. Dus sterke zuren kunnen zorgen voor de denaturatie van de eiwitten in de doorzichtige lens. Hierdoor kan dit leiden tot blindheid.
Bronnen






