Het azijnzuurgehalte bepalen
1.Onderzoeksvraag
Hoeveel is het azijnzuurgehalte van tafelazijn?
2.Voorbereiding
a.Begrippen als achtergrond voor experiment
- Titratie
- Zuur / base
- pH – indicator
b.Materiaal + stoffen
- 2 meetspuiten
- Tafelazijn
- Erlenmeyer 100 ml
- Maatcilinder 25 ml
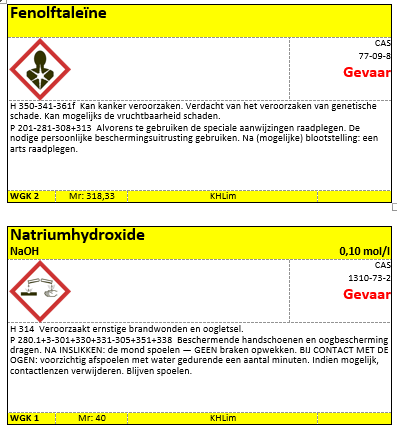
- Fenolftaleïne
- Water
- NaOH 0,10 mol/l
- 2 maatbekers 100 ml
c.Bereiding oplossingen
- Bereiden van NaOH 0,10 mol/l
Los 3,9 g NaOH op in 100 ml water, leng dan aan tot 1 l. - Bereiding fenolftaleïne 1%
1 g fenolftaleïne in 60 ml 95% ethanol oplossen en aanlengen met water tot 100 ml.
d.Opstelling (foto)

e. Etiketten
3.Uitvoeren
a.Werkwijze
- Doe met behulp van een meetspuitje 1 ml azijn in een erlenmeyer en voeg 10 ml water toe.
- Voeg een paar druppels fenolftaleïne toe.
- Neem een zuiver meetspuitje. Vul het met NaOH – oplossing 0,10 mol/l en lees het beginvolume af.
- Spuit een kleine hoeveelheid NaOH – oplossing bij de verdunde azijn.
- Kwispel de erlenmeyer om alles goed te mengen.
- Als de oplossing nog geen kleur heeft, herhaal dan 4 en 5 totdat er wel een fuchsia kleur zichtbaar wordt.
- Stop de toevoeging van NaOH – oplossing als er een blijvende fuchsia kleur ontstaat.
- Lees het eindvolume in de injectiespuit af.
b.Waarneming (+ foto’s)
We zijn begonnen met 15 ml NaOH – oplossing, hiervan is 11ml gebruikt om de kleur te doen omslaan

4.Reflecteren
a.Optredende reacties
HAc + NaOH –> NaAc + H2O
b.Besluit
Om de kleur te doen omslaan moet je 11 ml NaOH toevoegen. Wanneer dit gebeurt is er een kleuromslag gebeurt en hebben we een neutralisatie ondergaan.
Gegeven:
VNaOH = 11 ml = 0,011 l
VCH3COOH = 1 ml = 0,001 l
cNaOH = 0,10 mol/l
Gevraagd = cCH3COOH???
Oplossing:
![]()
0,011l · 0,10 mol/l = 0,001 l ·
–> cCH3COOH = 1,1 mol/l
10x verdund
1,1 mol/l delen door 10 = 0,11 mol/l
MCH3COOH: 60,05 g/mol
0,11 mol/l · 60,02 g/mol = 6,6022 g/l
We nemen 1 ml = 1 g
Hieruit volgt dat in 100 ml tafelazijn :zit 0,66022 ml CH3COOH
Fles is 7%o = 7 ml in 100 ml






