Hoofdstuk 13 – Experimenten
1. Endotherm en entropie positief
1.1. Endotherme reactie met vorming van ammoniak

- Info: Hoe kunnen we een endotherme reactie spontaan laten verlopen?
- Moeilijkheid: eenvoudig
- Chemische stoffen: NH4Cl – Ba(OH)2.8H20 – rood lakmoespapiertje
- Thema: chemische reacties – energetische aspecten – thermodynamica
- Tijd: 15 min
- Begrippen: endo-energetische reacties – spontane reactie
1.2. Endotherme reactie met zure hosties

- Info: Hoe kunnen we een endotherme reactie spontaan laten verlopen met een zure hostie? Meten van temperatuur bij toevoegen aan inhoud van een zure hostie.
- Moeilijkheid: eenvoudig
- Chemische stoffen:bakpoeder – wijnsteenzuur
- Thema: chemische reacties – energetische aspecten – thermodynamica
- Tijd: 10 min
- Begrippen: endo-energetische reacties – spontane reactie
1.3. Endotherme reactie met zwavel

- Info: Welke soort energetische reactie vindt plaats tussen ijzertrinitraat nonahydraat en natriumthiosulfaat pentahydraat? De drijfkracht van de reactie is het vrijzetten van water uit beide zouten en de vorming van SO2. Tijdens het proces valt thiosulfaat uiteen in SO2 en S.De entropie neemt door de gasvorming toe waardoor het endotherme proces spontaan verloopt.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Fe(NO3)3.9H2O – Na2S2O3.5H2O
- Thema: chemische reacties – energetische aspecten – thermodynamica
- Tijd: 15 min
- Begrippen: endo-energetische reacties – spontane reactie
1.4.Spontane endotherme reactie

- Info: Hoe optimaliseer je een endotherme reactie? Zoek de optimale verhouding van bakpoeder en citroenzuur en meet de temperatuur als aan het mengsel water wordt toegevoegd. Deze chemische reactie is een endo-energetische reactie.In het proefje is de vorming van het koolzuurgas de oorzaak van de voorstuwing
- Chemische stoffen: bakpoeder – vast citroenzuur watervrij
- Thema: chemische reacties – energetische aspecten – thermodynamica
- Tijd: 10 min
- Begrippen: endo-energetische reacties – spontane reactie
2. Energetische waarde
2.1. Energetische waarde van een pinda

- Info: Wat is de energetische waarde van pinda’s? Je bepaalt dit door de vrijgegeven warmte van een bepaalde hoeveelheid
- Moeilijkheid: eenvoudig
- Chemische stoffen: pinda’s
- Thema: thermodynamica
- Tijd: 30 min
- Begrippen: energetische waarde
2.2. Verbrandingsenthalpie meten van een theelichtje

- Info: Wat is de verbrandingsenthalpie van een theelichtje? : Door de warmte die overgedragen wordt op het water kunnen we de verbrandingsenthalpie berekenen.
- Moeilijkheid: eenvoudig
- Chemische stoffen: theelichtje
- Thema: thermodynamica
- Tijd: 30 min
- Begrippen: energetische waarde – verbrandingsenthalpie
3. Neutralisatiewarmte
3.1. Bepaling van de calorimetrische waarde van een mol neutralisatiewarmte

- Info: Hoeveel zal de calorimetrische waarde van een mol neutralisatiewarmte zijn?
- Moeilijkheid: eenvoudig
- Chemische stoffen: HCl 1 mol/l – NaOH 1mol/l
- Thema: thermodynamica
- Tijd: 30 min
- Begrippen: energetische waarde – neutralisatiewarmte
3.2. Neutralisatiereactie door temperatuurmeting

- Info: Hoe kunnen we via temperatuursmeting de concentratie van een HCl-oplossing bepalen? Temperatuursmeting bij titratie
- Moeilijkheid: eenvoudig
- Chemische stoffen: HCl 1 mol/l – NaOH 1mol/l
- Thema: thermodynamica – neutralisatiereactie
- Tijd: 30 min
- Begrippen: energetische waarde – neutralisatiewarmte – titratie
3.3. Temperatuur van een neutralisatie

- Info: Wat zal er gebeuren met de temperatuur tijdens een neutralisatiereactie? Volg de temperatuur bij de neutralisatie
- Moeilijkheid: eenvoudig
- Chemische stoffen: HCl 5 mol/l – NaOH 5mol/l
- Thema: thermodynamica – neutralisatiereactie
- Tijd: 30 min
- Begrippen: energetische waarde – neutralisatiewarmte – titratie
3.4.Temperatuurmeting bij reactie tussen citroenzuur en bakpoeder

- Info: Temperatuurmeting bij de reactie van citroenzuur en natriumwaterstofcarbonaat
- Moeilijkheid: eenvoudig
- Chemische stoffen: Citroenzuuroplossing (C6H8O7) – Natriumwaterstofcarbonaat (NaHCO3)
- Thema: thermodynamica – neutralisatiereactie
- Tijd: 30 min
- Begrippen: energetische waarde – neutralisatiewarmte
4. Oploswarmte
4.1. Energie-uitwisseling door calciumoxide

- Info: Wat gebeurt er als we water toevoegen aan calciumoxide? De hydratatiewarmte bedraagt: -65,16 kJ/mol
- Moeilijkheid: eenvoudig
- Chemische stoffen: water – calciumoxide
- Thema: thermodynamica
- Tijd: 20 min
- Begrippen: energetische waarde – oploswarmte
4.2. Vriespuntverlaging door calciumchloride

- Info: Wat gebeurt er als we ijs toevoegen aan calciumoxide? Calciumchloride zorgt voor een grote vriespuntsdaling echter het is, wegens het dubbele aantal chloorionen, dubbel zo giftig voor planten als natriumchloride.
- Moeilijkheid: eenvoudig
- Chemische stoffen: ijsblokjes – vast calciumchloride
- Thema: thermodynamica
- Tijd: 20 min
- Begrippen: energetische waarde – oploswarmte
4.3. Warmte-effect bij verdunnen van zwavelzuur
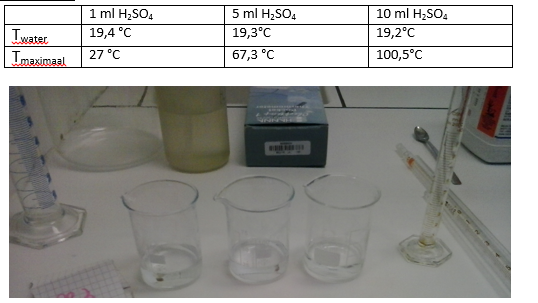
- Info: Wat zal er gebeuren als we geconcentreerd zwavelzuur toevoegen aan water? Wat nemen we waar? Hoe hoger de concentratie aan zwavelzuur, hoe sterker de reactie met water optreedt. Hierdoor komt er meer energie vrij. Dus de maximale temperatuur zal hoger zijn, indien je concentratie hoger is.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Geconcentreerd zwavelzuur
- Thema: thermodynamica
- Tijd: 20 min
- Begrippen: energetische waarde – oploswarmte
4.4. Zwavelzuur en water endotherm en exotherm

- Info: Indien ijs beschikbaar is kan voor het verdunnen van geconcentreerd zwavelzuur het zuur aan ijs worden toegevoegd. In dat geval is de smeltwarmte van het ijs ruim voldoende om de oploswarmte van het zuur te compenseren: de oplossing koelt af.
- Moeilijkheid: eenvoudig
- Chemische stoffen: 200ml 9M H2SO4 (100ml geconcentreerd toevoegen aan 100g ijs) – 100g ijs – 100ml ijskoud water
- Thema: thermodynamica
- Tijd: 20 min
- Begrippen: energetische waarde – oploswarmte
5. Smeltwarmte
5.1. Kokosvet koelt bij het smelten

- Info: Wat gebeurt er wanneer we kokosvet en witte bijenwas in verwarmd water brengen?
- Moeilijkheid: eenvoudig
- Chemische stoffen: Water – Bijenwas – Cacaoboter
- Thema: thermodynamica
- Tijd: 20 min
- Begrippen: energetische waarde – smeltwarmte






