Werkblad: buffermengsel
LEERLINGENVERSIE link
Inleiding
Om aan deze opdracht te kunnen beginnen open je eerst volgende link of scan de QR-code:

http://billvining.com/mmlib_sims/#gen_16_2
Effect van buffers op de pH
Situatie 1 – Beginwaarden
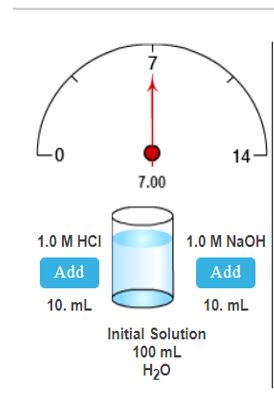
Waaruit bestaat de initiële oplossing in het eerste geval?
100 ml H2O
We willen nu HCl, wat een zuur / base is (doorstreep wat niet past), en / NaOH, wat een zuur / base is (doorstreep wat niet past), toevoegen aan ons originele oplossing.
Beginwaarde pH oplossing: 7
Wil je nu 1,0 M van HCl of NaOH toe aan de oplossing door op de ADD knop te duwen bij HCl. Vervolgens lees je de pH-waarde van de oplossing af onder de rode pijl.
Toevoegen Van HCl
Na één maal 1 molair HCl toegevoegd te hebben bedraagt de pH-waarde van de oplossing: 1,04
Na een tweede keer 1 molair toe te voegen bedraagt depHh-waarde van de oplossing: 0,78
Na de derde keer HCl toe te voegen bedraagt de pH-waarde van de oplossing: 0,64
Je merkt op dat je nu geen stof meer kan toevoegen aan de oplossing, we gaan dus de tool resetten. Dit doe je door de RESET ALL knop in te drukken
Toevoegen Van NaOH
Na één maal 1 molair NaOH toegevoegd te hebben bedraagt de pH-waarde van de oplossing: 12,96
Na een tweede keer 1 molair toe te voegen bedraagt de pH-waarde van de oplossing: 13,22
Na de derde keer NaOH toe te voegen bedraagt de pH-waarde van de oplossing: 13,36
Situatie 2
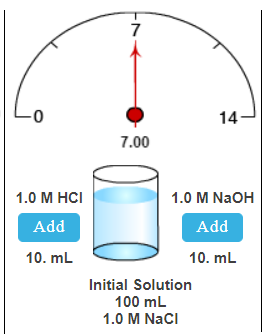
Waaruit bestaat de initiële oplossing in het tweede geval?
100 ml oplossing bestaande uit:
1.0 M NaCl
Beginwaarde ph oplossing: 7,00
Wil je nu 1,0 M van HCl of NaOH toe aan de oplossing door op de knop te duwen bij HCl. Vervolgens lees je de pH-waarde van de oplossing af onder de rode pijl.
Toevoegen Van HCL
Na één maal 1 molair HCl toegevoegd te hebben bedraagt de pH-waarde van de oplossing: 1,04
Na een tweede keer 1 molair toe te voegen bedraagt de pH-waarde van de oplossing: 0,78
Na de derde keer HCl toe te voegen bedraagt de pH-waarde van de oplossing: 0,64
Je merkt op dat je nu geen stof meer kan toevoegen aan de oplossing, we gaan dus de tool resetten. Dit doe je door de knop in te drukken
Toevoegen Van NaOH
Na één maal 1 molair NaOH toegevoegd te hebben bedraagt de pH-waarde van de oplossing: 12,96
Na een tweede keer 1 molair toe te voegen bedraagt de pH-waarde van de oplossing: 13,22
Na de derde keer NaOH toe te voegen bedraagt de pH-waarde van de oplossing: 13,36
Situatie 3
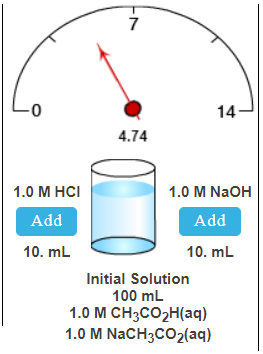
Waaruit bestaat de initiële oplossing in het tweede geval?
100 ml oplossing bestaande uit:
1.0 M Azijnzuur(CH3CO2H)
1.0 M Natriumacetaat (NaCH3CO2)
Beginwaarde pH oplossing: 4,74
Wil je nu 1,0 M van HCl of NaOH toe aan de oplossing door op de ADD knop te duwen bij HCl. Vervolgens lees je de pH-waarde van de oplossing af onder de rode pijl.
Toevoegen Van HCl
Na één maal 1 molair HCl toegevoegd te hebben bedraagt de pH-waarde van de oplossing: 4,65
Na een tweede keer 1 molair toe te voegen bedraagt de pH-waarde van de oplossing: 4,56
Na de derde keer HCl toe te voegen bedraagt de pH-waarde van de oplossing: 4,47
Je merkt op dat je nu geen stof meer kan toevoegen aan de oplossing, we gaan dus de tool resetten. Dit doe je door de knop in RESET te drukken
Toevoegen Van NaOH
Na één maal 1 molair NaOH toegevoegd te hebben bedraagt de pH-waarde van de oplossing: 4,83
Na een tweede keer 1 molair toe te voegen bedraagt de pH-waarde van de oplossing: 4,92
Na de derde keer NaOH toe te voegen bedraagt de pH-waarde van de oplossing: 5,01
Reflecteren
Wanneer we gaan kijken naar de waardes voor het toevoegen van HCl en NaOH, bij situatie 1 in vergelijking met situatie 2:

Wanneer we de pH-waarde bij situatie 1 vergelijken met een overeenkomstige toegevoegde hoeveelheid dan zien we dat deze even groot is.
Vul in onderstaande tabel voor het toevoegen van HCl, bij verschil duidt je het verschil met de vorige meting aan:
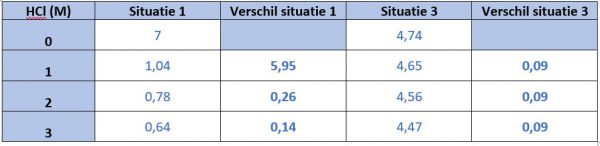
Vergelijk de verschillen het verschil in situatie 1 met situatie 3, het verschil bij situatie 1 is hoger / lager (schrap wat niet past) dan bij situatie 3 wanneer we HCl toevoegen.
Vul in onderstaande tabel voor het toevoegen NaOH, bij verschil duidt je het verschil met de vorige meting aan:
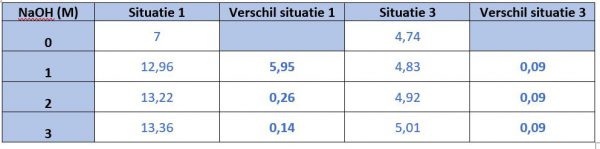
Vergelijk de verschillen het verschil in situatie 1 met situatie 3, het verschil bij situatie 1 is hoger / lager (schrap wat niet past) dan bij situatie 3 wanneer we NaOH toevoegen.
Theoretisch de pH-waarde bepalen
De pH-waarde kan ook theoretisch bekomen worden. Om de pH te achterhalen na het toevoegen van een sterk zuur (HCl in dit geval) aan een buffermengsel doe je aan de hand van volgende formule:

Om de pH te achterhalen na het toevoegen van een sterke base (NaOH in dit geval) aan een buffermengsel doe je aan de hand van volgende formule:

Bereken nu zelf eens door gebruik te maken van de correcte formule de bekomen pH-waarde:
- Na het toevoegen van 10ml HCl (1 mol/l) aan het buffermengsel:

- Na het toevoegen van 30 ml NaOH (1 mol/l) aan het buffermengsel:

Verklaring
Het mengsel in situatie 3 zorgt er dus voor dat de pH-waarde minder varieert door het toevoegen van een sterk zuur of sterke base, dit noemen we bufferen. Het mengsel dat dus zorgt voor het bufferen noemen we het buffermengsel.
De oplossing in situatie 2 heeft duidelijk geen invloed op de verandering van de pH-waarde, NaCl is bij gevolg geen buffermengsel.






