Enthalpie
|
|
Definities
- enthalpie (H): De enthalpie van een systeem is de som van de inwendige energie en de volumetoestand van het systeem.
- wikipedia enthalpie
Experimenten
Filmfragmenten
Lesvideo's youtube
Eigen lesvideo's
Oefeningen lesvideo's
1. Bereken de reactiewarmte in J/mol methanol van de reactie:
2CH3OH(vl) + 3 O2(g) –> 2 CO2(g) + 4 H2O(vl)
Vormingswarmten:CH3OH: -2,39 105 J/mol; CO2 : -3,935 105 J/mol; H2O(vl): – 2,86 105 J/mol
2. Bereken de reactiewarmte in J/mol ammoniumnitraat van de reactie
NH4NO3(s) –> N2O(g) + 2 H2O(vl)
Vormingswarmte: NH4NO3 : -3,66 105 J/mol N2O: +0,816 105 J/mol en H2O(vl): -2,86 105 J/mol
3. Bereken de reactiewarmte van deze reactie per mol ethanol
6CO(g) + 3 H2O(vl) –> C2H6O(vl) + 4 CO2(g)
Vormingswarmte: CO: -1,105 105 J/mol H2O(vl): -2,86 105 J/mol C2H6O(vl): -2,78 105 J/mol en CO2: -3,935 105 J/mol
4. Bereken met de formule en via een energiediagram de reactiewarmte van
NH4NO3(s) –> N2O(g) + 2 H2O(vl)
6. Bereken de reactiewarmte per mol water van: 4 H2O(g) + 2 CO2(g) –> 2 CO(g) + 4 H2(g) + 3 O2 (g)
7. Bereken de reactiewarmte per mol water van: 4 H2O(g) + 2 CO2(g) –> 2 CO(g) + 4 H2(g) + 3 O2(g)
Gebruik tabellen van vormingswarmte
2 C4H6(g) + 11 O2(g) –> 8 CO2(g) + 6 H2O(l)
De vormingswarmte van buta-1,3-dieen is + 1,1 105 J/mol.
9. Voor 3 H2 + N2 –> 2NH3 (Q = +92 kJ) .Bereken de nodige energie bij de productie van 1,0 kg NH3
10. Bereken de reactiewarmte van de aangegeven reactie
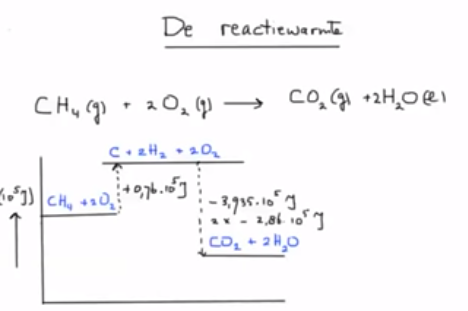
11. Bereken de reactie-enthalpie voor: 2 CO + O2 –> 2 CO2
uitgaande van de vormingsenthalpieën van CO2 en CO
12. Bereken voor de gegeven reacties de reactie-enthalpie uitgaande van de vormingsenthalpieën:
13. Bereken de reactieenthalpie van de gegeven reacties:
Gegevens: SO2 + 2 CO –> 2 CO2 + S (Δ H = -276 kJ)
14. Bereken de reactieenthalpie van de gegeven reactiesH2O(vl) –> H2O(g)
Gegevens: verbrandingsenthalpie van H2
15. Bereken de reactieenthalpie van de gegeven reacties: Vormingsenthalpie van CaO
Gegevens: Ca(v) + 2 H2O(vl) –> Ca2+(aq) + 2 OH–(aq) + H2(g) ΔH: -432 kJ
CaO(v) + H2O(vl) –> Ca2+(aq) + 2 OH–(aq) ΔH: -82 kJ
16. Bereken de reactieenthalpie van de gegeven reacties: Vormingsenthalpie van NH3
Spellen
Animaties
Algemeen
- Begrip enthalpie
- Specifieke warmte
- Begrip enthalpie
- Enthalpieberekeningen reacties
- Warmteoverdracht metaal en water
- Warmteuitwisseling metalen
- Warmteoverdracht bij verhitten van metalen
- Warmteoverdracht bij vaste stoffen
- Specifieke warmtecapaciteit
Enthalpie bij vormen van stoffen
Enthalpie bij oplossen van stoffen
- Oplosenthalpie
- Oplosenthalpie
- Oplosenthalpie
- Energieuitwisseling bij het oplossen van zouten
- Oplosenthalpie
Ipad apps
Thermodynamica

Deze app behandelt de volgende onderwerpen :
– Bepaal de eigenschappen van elementen, chemicaliën en ionen
– Bereken de eigenschappen van gassen met behulp van verschillende gaswetten
– Voer stoichiometrische conversies uit voor oplossingen
– Balanceer vergelijkingen
– Bereken de enthalpie, evenwichtsconstante en theoretische opbrengst van een reactie
– Voer meer dan 45 verschillende berekeningen uit
https://itunes.apple.com/nl/app/wolfram-general-chemistry/id434841846?mt=8
https://play.google.com/store/apps/details?id=com.wolfram.android.chemistry

De app bevat berekeningen gerelateerd aan Thermodynamica : Nernstpotentiaal, enthalpie, entropie…..
https://itunes.apple.com/nl/app/thermodynamics-calculator/id521684348?mt=8
https://play.google.com/store/apps/details?id=com.sis.thermodynamicscalc
De app berekent de volgende parameters:Standaard Gibbs-energie, enthalpie en entropie van energieparameters , reactiequotiënt (Q) uit concentraties en reactiestoichiometrie…..
Niet-standaard energieparameters (dG, dH, dS) van standaardwaarden, quotiënt en temperatuur.
Reactie evenwichtsconstante, Keq.
https://itunes.apple.com/be/app/reaction-thermodynamics/id1090321476?l=nl&mt=8

Oefenen thermodynamica

De app bevat berekeningsmogelijkheden over formules zoals gaswetgeving, verdunning, kinetiek, thermodynamica, enz.
https://itunes.apple.com/be/app/gchemy/id1074560132?l=nl&mt=8
https://play.google.com/store/apps/details?id=com.amase.gchemy
Android apps
Thermodynamica

Deze app behandelt de volgende onderwerpen :
– Bepaal de eigenschappen van elementen, chemicaliën en ionen
– Bereken de eigenschappen van gassen met behulp van verschillende gaswetten
– Voer stoichiometrische conversies uit voor oplossingen
– Balanceer vergelijkingen
– Bereken de enthalpie, evenwichtsconstante en theoretische opbrengst van een reactie
– Voer meer dan 45 verschillende berekeningen uit
https://play.google.com/store/apps/details?id=com.wolfram.android.chemistry

De app bevat berekeningen gerelateerd aan Thermodynamica : Nernstpotentiaal, enthalpie, entropie…..
https://play.google.com/store/apps/details?id=com.sis.thermodynamicscalc
Oefenen thermodynamica

De app bevat berekeningsmogelijkheden over formules zoals gaswetgeving, verdunning, kinetiek, thermodynamica, enz.
https://play.google.com/store/apps/details?id=com.amase.gchemy








