Zwavelzuur
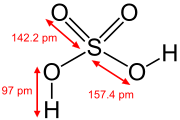
| Formule | H2SO4 vitriool, vitrioololie, diwaterstofsulfaat |
| Familie | Anorganische zuren |
| Productie | |
| Eigenschappen | Een sterk zuur dat voorkomt in vele industriële toepassingen. Niet ontvlambaar, zwaarder dan water. Kan in reactie gaan met verschillende stoffen en kan leiden tot ontploffing en verbranding. Een olieachtige, kleurloze viskeuze oplossing. Zwavelzuur komt niet voor als een natuurlijk product op aarde. Het is wel ontdekt in de buitenste atmosfeer van Venus en rond de maan Europa van Jupiter. Hier ontstaat het via het contactproces tussen zwavel en zuurstofgas. |
| Toepassingen | 60% wordt gebruikt voor de productie van fosforzuur: explosief en kunstmeststof: KLIK
Bij de productie van batterij, nylon, kleurstoffen en zoutzuur:KLIK Raffinage van olie Oxidans en dehydraterend reagens: KLIK |
| Geschiedenis | De oorsprong van het gebruik van zwavelzuur is omhuld met raadsels en de geschiedenis ervan is moeilijk te beschrijven, omdat er tot de 16e eeuw geen betrouwbare recepten voorhanden zijn die de bereiding van zwavelzuur beschrijven.17de eeuw: Johannes Rudolf Glauber liet het zuur reageren met tafelzout wat resulteerde in zoutzuur en het Glauberzout: natriumsulfaat
1736: Joshua Ward voerde de eerste commerciële productie uit: KLIK 1746: John Roebuck produceerde zwavelzuur volgens het lodenkamerproces KLIK– KLIK 19de eeuw: JL Gay-Lussac en J. Glover verhoogden de opbrengst tot 78%: KLIK – KLIK Contactproces : KLIK |
| Bronnen | KLIK – KLIK |






