Werkblad : Chemisch evenwicht
LEERLINGENVERSIE link
- Onderzoeksvraag:
Hoe kunnen we chemisch evenwicht grafisch voorstellen?
- Benodigdheden:
Open de volgende simulatie:
https://elearning.cpp.edu/learning-objects/dynamic-equilibrium/
Chemical Kinetics
- Werkwijze:
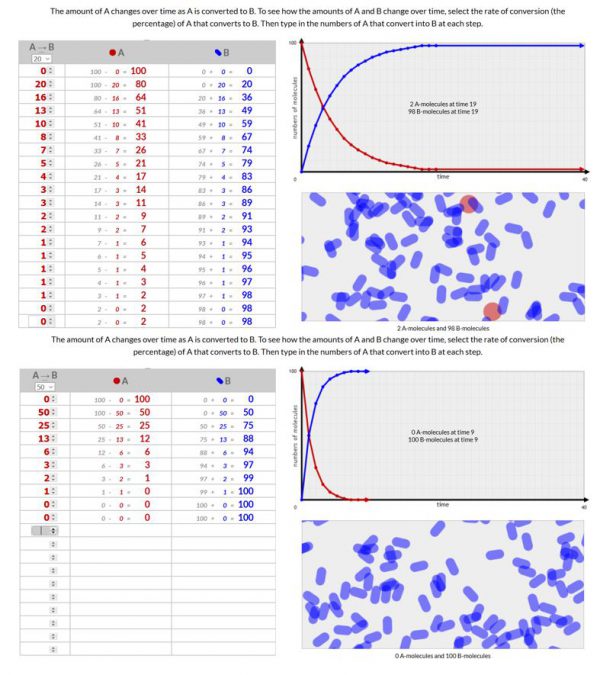
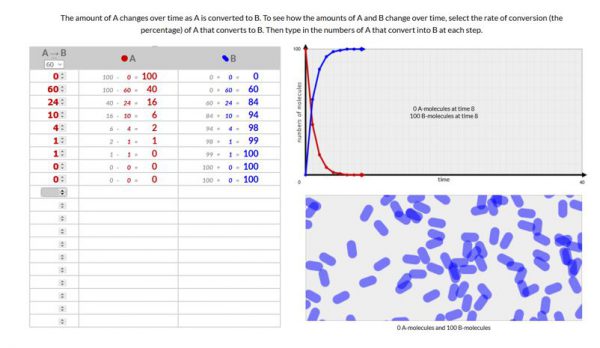
- Voer deze simulatie 3x uit met 3 verschillende omzettingssnelheden.
Je omzettingssnelheid is het aantal moleculen A dat naar B worden omgezet per tijdseenheid. Je eerste waarde is dus gelijk aan je omzettingssnelheid. Je tweede waarde is gelijk aan het percentage dat je gekozen hebt vermenigvuldigd met je aantal moleculen A. Enz.
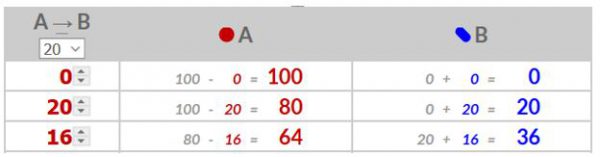
- 20% . 100 = 20
20% . 80 = 16 - Ga verder totdat alle moleculen A omgezet zijn naar moleculen B.
Waarneming:
Voeg een schermopname toe van je 3 simulaties.
- Besluit:
Hoe lager je omzettingssnelheid hoe langer (hoe meer stapjes) het duurt voordat alle moleculen van A omgezet worden naar B. Volgens de wet van behoud van materie beginnen we met 100 moleculen en eindigen we ook met 100 moleculen.
Chemical Equilibrium
- Werkwijze:
- Voer deze simulatie 3x uit. Een keer waarbij de omzettingssnelheid A–>B > B –>A, een keer waarbij de omzettingssnelheid A–>B = B–>A en een keer waarbij de omzettingssnelheid A–>B < B–>A
- In dit geval worden moleculen A naar B omgezet en B naar A met verschillende omzettingssnelheden. Je waarden voor A zijn gelijk aan het percentage dat je gekozen hebt voor A–>B vermenigvuldigd met het aantal moleculen A en je waarden voor B zijn gelijk aan het percentage dat je gekozen hebt voor B–>A vermenigvuldigd met het aantal moleculen B.
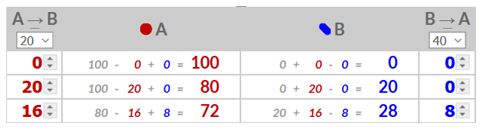
- 20% . 100 = 20 en 40% . 0 = 0
- 20% . 80 = 16 en 40% . 20 = 8
- Ga verder tot je een evenwicht bereikt hebt.
- Bereken je evenwichtsconstante door je bereikte aantal moleculen van B te delen door je bereikte aantal moleculen van A.
- Waarneming:
Voeg een schermopname toe van je 3 simulaties.
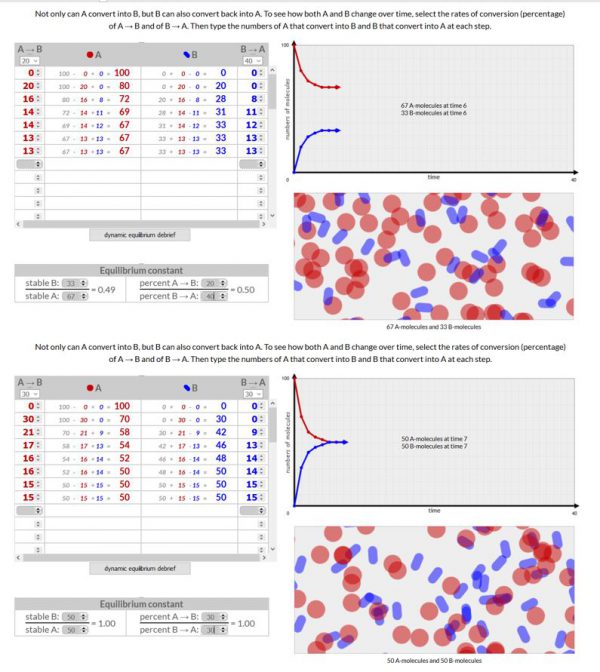
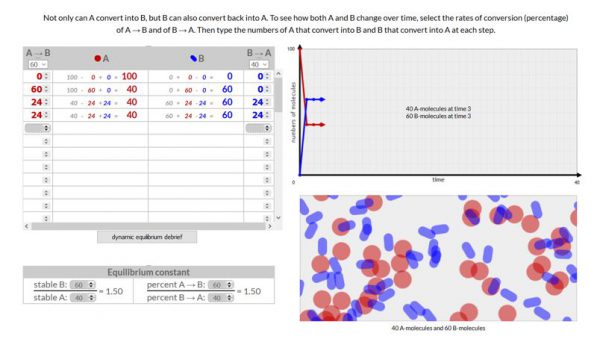
- Besluit
Wanneer het aantal moleculen A en B niet meer veranderen, hebben we een evenwicht bereikt. Hoe hoger je omzettingssnelheid, hoe sneller het evenwicht bereikt wordt. De evenwichtsconstante berekenen we door het aantal moleculen van B bij evenwicht te delen door het aantal moleculen A
Le Châtelier’s Principle
- Werkwijze:
- Voer deze simulatie uit op dezelfde manier als het vorige experiment totdat je een evenwicht bereikt hebt.
- Wanneer je een evenwicht bereikt hebt kun je dit evenwicht verstoren door het aantal moleculen A en/of B te veranderen. Dit doe je door op “change molecule quantities” te klikken.
- Voer deze simulatie 3x uit. Een keer waarbij in het begin het aantal moleculen van A > B, een keer waarbij A = B en een keer waarbij A < B.
- Waarneming:
Voeg een schermopname toe van je 3 simulaties
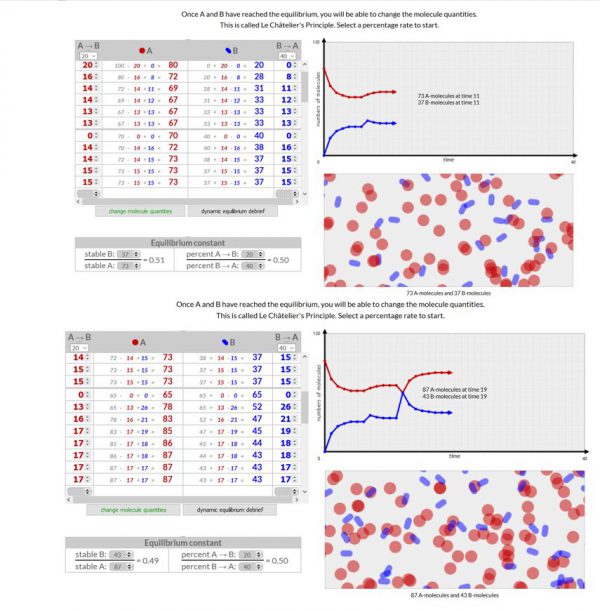
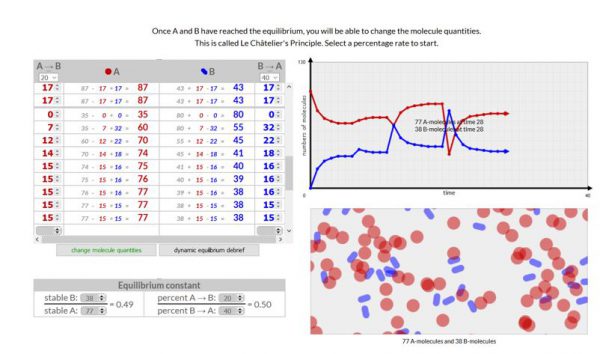
- Besluit
Volgens de wet van Chatelier stelt dat wanneer we een evenwicht verstoren, het evenwicht zal verschuiven om zich te herstellen.






