Waterstofsulfiet
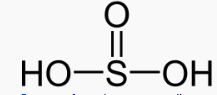
| Formule | H2SO3 |
| Familie | anorganische zuren |
| Productie |
Zwaveligzuur wordt bereid door zwaveldioxide in water op te lossen. De reactie is echter onkeerbaar en het zuur ontleedt gemakkelijk terug in de reactanten. SO 2 + H 2 O → H 2 SO 3 Aldus is zwaveligzuur gewoonlijk niet beschikbaar in zijn zure vorm, maar meer gebruikelijk bereid als zijn natrium- of kaliumzouten. In de onderstaande reactie wordt natriumsulfaat toegevoegd aan een oplossing van zwaveldioxide in water om het stabiele natriumbisulfietzout als product te geven. Na 2 SO 3 + H 2 O + SO 2 → 2NaHSO 3 |
| Eigenschappen |
Zwaveligzuur wordt in de natuur gevonden als tussenproduct bij de vorming van zure regen, door de reactie van zwaveldioxide met atmosferisch vocht. Zwaveligzuur is een kleurloze vloeistof met een sterke penetrante geur. Het heeft een dichtheid van 1,03 g / ml en een kookpunt van -60 ° C. Het zuur is onstabiel en is nog nooit in zuivere toestand geïsoleerd. Het ontleedt gemakkelijk in water en zwaveldioxide: H 2SO 3 (aq) → H2O + SO2 Het vormt ook zwavelzuur bij blootstelling aan lucht: 2H 2SO3 + O2 → 2H2SO 4 Zwaveligzuur is een zwak en dibasisch zuur. Het reageert met basen om bisulfiet en sulfietzouten te vormen. |
| Toepassingen |
Waterige oplossingen van zwaveldioxide, die soms zwavelzuur worden
|
| Bronnen | KLIK |






