Waterstofperoxide
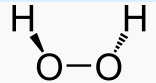
| Formule | H2O2 zuurstofwater |
| Familie |
Niet-metaaloxiden
|
| Eigenschappen |
Het molecuul heeft één zuurstofatoom meer dan het water. De binding tussen de twee zuurstofatomen laat vrij makkelijk los, met vorming van twee OH-radicalen. Deze radicalen reageren met andere zuurstofradicalen of met andere stof waardoor een oplossing van waterstofperoxide uiterst reactief is. Waterstofperoxide is erg reactief. Het zal na verloop van tijd ontleden in water en zuurstofgas via een auto-redoxreactie, eventueel gekatalyseerd door mangaandioxide of het katalase enzyme |
| Toepassingen |
Bleken van pulp en papier Wasproducten: Natriumpercarbonaat, een adduct van natriumcarbonaat en waterstofperoxide, is het actieve ingrediënt in producten als OxiClean en Tide-wasmiddel. Wanneer opgelost in water, geeft het waterstofperoxide en natriumcarbonaat af. Link Ontsmettingsmiddel: Waterstofperoxide wordt gebruikt in bepaalde afvalwaterbehandelingsprocessen om organische onzuiverheden te verwijderen. Link Waterstofperoxide kan worden gebruikt voor de sterilisatie van verschillende oppervlakken, Cosmetische toepassingen Link Glow sticks:Waterstofperoxide reageert met bepaalde di-esters, zoals fenyloxalaatester om chemiluminescentie te produceren; deze applicatie komt het meest voor in de vorm van glow sticks. Sommige tuinbouwers en gebruikers van hydrocultuur pleiten voor het gebruik van zwakke waterstofperoxide-oplossing in wateroplossingen. De spontane ontleding geeft zuurstof af dat de wortelontwikkeling van een plant verbetert en helpt bij het behandelen van wortelrot. Klik |
| Geschiedenis |
Het werd in 1818 ontdekt door Louis Jacques Thénard. Link Het werd voor het eerst geproduceerd in het Verenigd Koninkrijk door bariumzout te verbranden, waardoor bariumperoxide (BaO2) ontstond. Dit werd vervolgens opgelost in water, waardoor waterstofperoxide ontstond. Het duurde tot 1894 voordat 100% waterstofperoxide door de wetenschapper Richard Wolffenstein uit het water werd gehaald met behulp van een proces dat vacuümdestillatie heet. Tegen het einde van de negentiende eeuw waren veel formules voorgesteld voor waterstofperoxide. De juiste formule van HOOH (H2O2) werd echter voor het eerst bewezen door Petre Melinkishvili. In maart 1888 bevatte de Journal of the American Medical Association een verwijzing dat Messner in 1863 de aanwezigheid van waterstofperoxide in regenwater bewees. Deze toepassing voor het steriliseren van waterstofperoxide heeft een lange geschiedenis van gebruik in de industrie. In het bijzonder binnen de farmaceutische industrie om petrischalen te steriliseren en in de luchtvaartindustrie om satellieten te steriliseren. Zuiver waterstofperoxide werd ontwikkeld als een raketbrandstof en wordt vandaag nog steeds als zodanig gebruikt ondanks een aantal ongelukken. In 1934 werden drie mensen gedood in Kummersdorf, Duitsland, toen een waterstofperoxide-raket explodeerde. Ondanks dit ging Duitsland nog steeds waterstofperoxide gebruiken in de V2-raket tegen het einde van de Tweede Wereldoorlog. De Russische onderzeeër, Kursk, is tijdens oefeningen in augustus gezonken. Er wordt aangenomen dat waterstofperoxide lekte uit een van de waterstofperoxide die torpedo’s aanvoerde en de dodelijke explosie veroorzaakte. Klik |
| Bronnen | Klik – klik – klik |






