Titel
APP: http://www.deciencias.net/proyectos/0cientificos/Tiger/paginas/CovalentBonding.html
Onderzoeksvraag:
Hoe kunnen twee dezelfde niet-metalen een binding vormen?
De binding tussen 2 Cl-atomen (niet-metalen) in Cl2.
Instructie:
Kijk aandachtig naar de simulatie. Probeer, na het bekijken van de simulatie, een antwoord te formuleren op volgende vraag: wat gebeurt er met de chlooratomen?
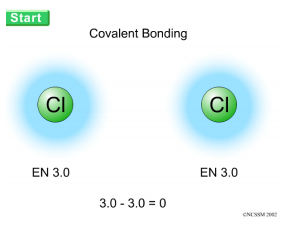
Waarneming:
De chlooratomen gaan een binding vormen.
Besluit:
Teken de valentie-elektronen van elk atoom.

Elke atoom wil de edelgasconfiguratie bereiken, maar elk Cl-atoom heeft 7 valentieelektronen en dus 1 te kort om een edelgasconfiguratie te verkrijgen. Zij kunnen niet van elkaar een elektron opnemen, dus zal elk Cl-atoom dat ene ongepaarde elektron
gemeenschappelijk stellen, er ontstaat een gemeenschappelijk elektronenpaar. (Duid deze aan in het blauw)
Voorstelling volgens de Lewis-notatie:
![]()
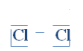
Dit ∆ EN tussen de bindingspartner is 0. Dat wil zeggen dat bij de atoombinding of covalente
binding tussen dezelfde niet-metalen ∆EN = 0.
De EN-waarde geeft aan hoe sterk een element de neiging heeft om gebonden elektronenpaar
zich toe te trekken.






